Neue Vaskulitis-Mimic durch COVID-19?
 Zerebrale Vaskulitis mit teils verengten, teils erweiterten Gefäßabschnitten (rekonstruierte 3D-Angiographie).
© Science Photo Library/Science Source/ Living Art Enterprises, LLC
Zerebrale Vaskulitis mit teils verengten, teils erweiterten Gefäßabschnitten (rekonstruierte 3D-Angiographie).
© Science Photo Library/Science Source/ Living Art Enterprises, LLC
Coronapatienten entwickeln eine Vielzahl von Gefäßbeteiligungen. Bei einigen ließen sich Kawasaki- oder Kawasaki-ähnliche Läsionen nachweisen, andere haben arterielle oder venöse Thromboembolien mit Schlaganfällen oder akuter Nierenschädigung. Als mögliche Pathomechanismen werden neben direkten viralen Einflüssen auf das Endothel Störungen in der Immunantwort, Komplementaktivierung, eine virale RNAämie mit Immunthrombose, Gerinnungsaktivierung durch Hypoxämie und Immobilität diskutiert, schreiben Professor Dr. Dennis McGonagle von der Universitätsklinik Leeds und Kollegen.
Primäre Vaskulitiden in COVID-19-Patienten
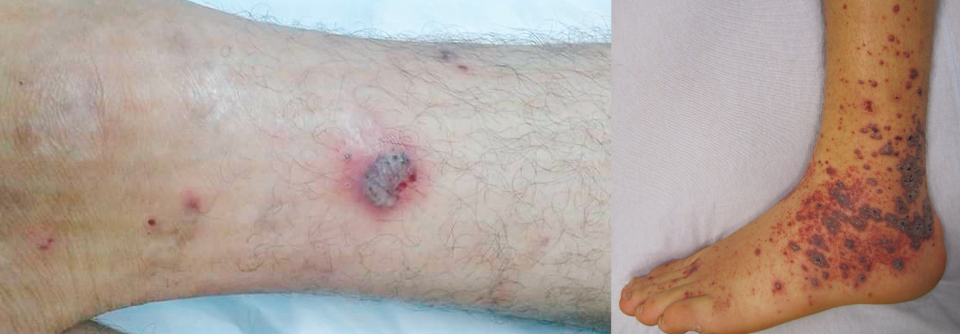
Einfachste und harmloseste Form ist die kutane Vaskulitis, die bei jüngeren, ansonsten gesunden Erkrankten oft ohne Pneumonie auftritt. Prädilektionsstelle ist die Rückseite der Zehen, es zeigen sich runde, umschriebene rote oder bläulich-rote Plaques, ein Erythem oder frostbeulenartige Veränderungen. Diese milde kutane Vaskulitis entsteht typischerweise bei robustem Anstieg von Typ-1-Interferon als Zeichen einer intakten Immunantwort auf SARS-CoV-2.
Weitere bei COVID-19 auftauchende primäre Vaskulitiden sind die Kawasaki- und die Kawasaki-ähnliche Erkrankung. Auch hier sind vor allem jüngere Patienten mit milder oder fehlender Lungenbeteiligung betroffen. Erstere Form ist oft mit Koronaraneurysmen assoziiert, letztere mit Beteiligung des Herzmuskels. Bei einer weiteren Variante steht die Myoperikarditis im Vordergrund.
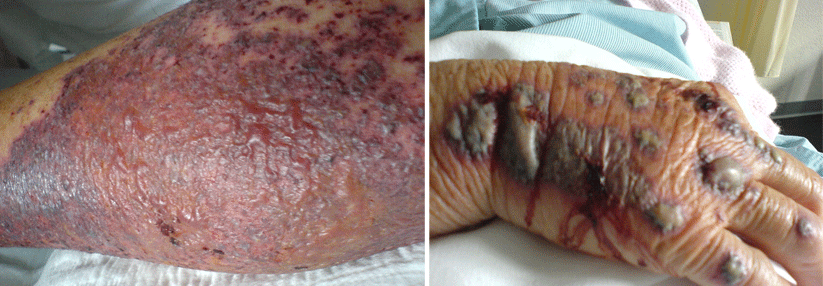
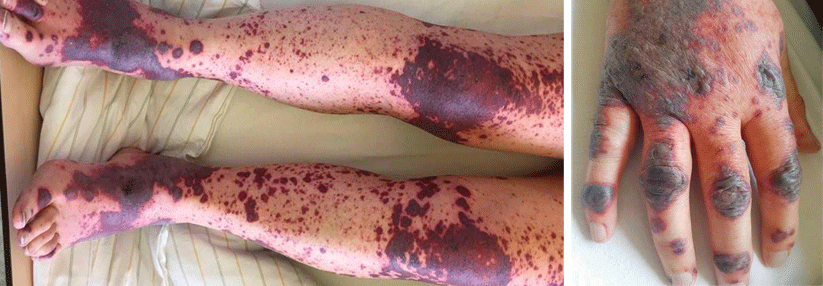
Bei kritisch kranken Patienten mit schwerer Lungenbeteiligung beobachtet man im Endstadium häufig eine disseminierte intravasale Koagulopathie (DIC). Wie die Autoren erläutern, ist diese Form der Vaskulitis-Mimics mit einer äußerst schlechten Prognose verbunden. Gut dokumentiert sind auch generell systemische arterielle oder venöse Thrombosen, wie tiefe Beinvenenthrombosen oder pulmonale Thromboembolien.
Was sind „Vaskulitis-Mimics“?
Quelle: Kötter I, Reinhold-Keller E. Z Rheumatol 2019; 78: 24-30; DOI: 10.1007/s00393-018-0581-8
Fehlende Interferonreaktion als Schlüssel
Einen weiteren Hinweis geben die ebenfalls zu einer Vaskulitis-Mimic passenden Hautläsionen schwer-kranker, älterer Patienten mit Pneumonie. Im Gegensatz zu denen bei jungen, ansonsten gesunden COVID-Erkrankten liegt meist keine primäre Vaskulitis vor, schreiben Prof. McGonagle und Kollegen. Bei diesen Patienten finden sich oft nekrotische Hautdefekte, häufig sind die Läsionen mit Thrombosen und z.T. mit einer Komplementaktivierung verbunden. Den entscheidenden Unterschied zur primären Vaskulitis sehen die Autoren im Fehlen einer starken Typ-1- Interferon-Antwort. Bringt der Körper zu Beginn der Infektion keine solche zustande, versucht er, dies mit proinflammatorischen Zytokinen auszugleichen. Deren Überproduktion löst den Forschern zufolge die Immunthrombosen in den kleinen postkapillären venösen Gefäßen aus (PIC, pulmonale intravasale Koagulopathie). Dies hat zur Folge, dass Emboli in die Peripherie gelangen und z.B. in der Haut zu nekrotischen Läsionen führen – im Sinne einer Vaskulitis-Mimic. Die PIC definieren Prof. McGonagle und Kollegen als distinkte Entität einer disseminierten intravasalen Koagulopathie.Post-mortem-Untersuchungen unterstützen die Theorie
Sie vermuten, dass die PIC generell der Wegbereiter einer COVID-19-assoziierten Vaskulitis-Mimic sein könnte. Darauf scheinen auch weitere Studien hinzudeuten. Post mortem zeigten sich Immunzellinfiltrate (inkl. restlicher Virchows-Trias) in den entsprechenden Lungengefäßen sowie Mikrothrombosen (auch außerhalb der Lungengefäße). In Studien ließen sich in pulmonalen CT-Angiographien bei Patienten mit schwerer SARS-CoV-2-Pneumonie wiederum verbreiterte, gewundene Gefäße in der subpleuralen Lungenregion nachweisen, ähnlich wie bei pulmonaler Hypertension oder Pulmonalvenenthrombosen. Eine PIC samt neuer Form der Vaskulitis-Mimic könnte die bei COVID-19 häufig auftretenden ischämischen Läsionen in Gehirn und peripheren Organen gut erklären, meinen die Autoren. Die durch die Immunthrombose ausgelöste PIC im postkapillären venösen Netzwerk der Lunge diene dabei als Ausgangspunkt der Emboli. Gelangen diese in den Körperkreislauf, führen sie u.a. auf direktem Wege zu Schlaganfällen, Nierenschäden, Hautläsionen, Darmischämien und anderen Organläsionen. Inwieweit sich die Vermutung bestätigen lässt, bleibt abzuwarten.Quelle: McGonagle D et al. Lancet Rheumatol 2021; 3: e224-e233; DOI: 10.1016/S2665-9913(20)30420-3