Angeborener Herzfehler „Selbst gut Operierte haben eine chronische Erkrankung“
 Selbst wenn die Operationen gut verlaufen, leiden Erwachsene mit angeborenem Herzfehler an einer chronischen Erkrankung, die sich auch auf die Psyche auswirkt.
© Monstar Studio – stock.adobe.com
Selbst wenn die Operationen gut verlaufen, leiden Erwachsene mit angeborenem Herzfehler an einer chronischen Erkrankung, die sich auch auf die Psyche auswirkt.
© Monstar Studio – stock.adobe.com
Die Folgen von Krankheit und operativer Korrektur begleiten Patienten von Kindesbeinen bis ins hohe Alter, weiß Professor Dr. Helmut Baumgartner, Universitätsklinikum Münster. Der Kollege ist Erstautor der neuen europäischen Leitlinie zur Betreuung von Erwachsenen mit angeborenem Herzfehler (EMAH) und betonte: „Selbst gut operierte Patienten haben eine chronische Erkrankung.“ Sie leiden unter Belastungsintoleranz, psychischen Problemen und reduzierter Lebensqualität, aber auch unter schwerwiegenden Akutkomplikationen wie Endokarditis oder Schlaganfall.
Mit zunehmendem Alter bestimmen nicht mehr Schwere des Herzfehlers und Operationsresultat die Prognose, sondern das Auftreten von Arrhythmien, Herzinsuffizienz und plötzlichem Herztod. Außerdem gefährden kardiovaskuläre Risikofaktoren die Patienten unabhängig vom Herzfehler mindestens ebenso wie andere Menschen. Jeder Betroffene sollte deshalb mindestens einmal im spezialisierten Zentrum vorgestellt und vom Kardiologen (mit)betreut werden. Für die Prognose bedeutet letzteres einen großen Unterschied, wie eine Auswertung von Krankenkassendaten zeigt (s. Kasten).
Der Kardiologe macht den Unterschied
Alte OP-Berichte sind vielfach nicht mehr zu bekommen
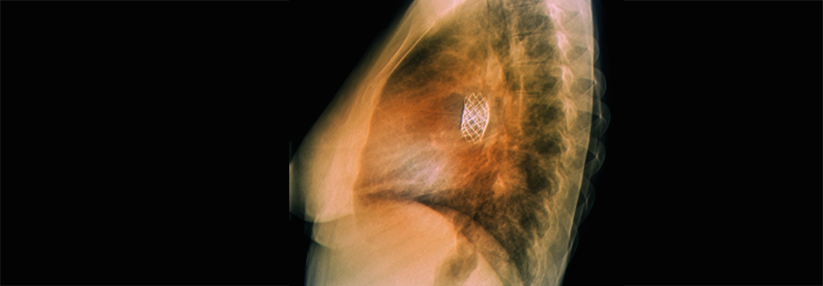
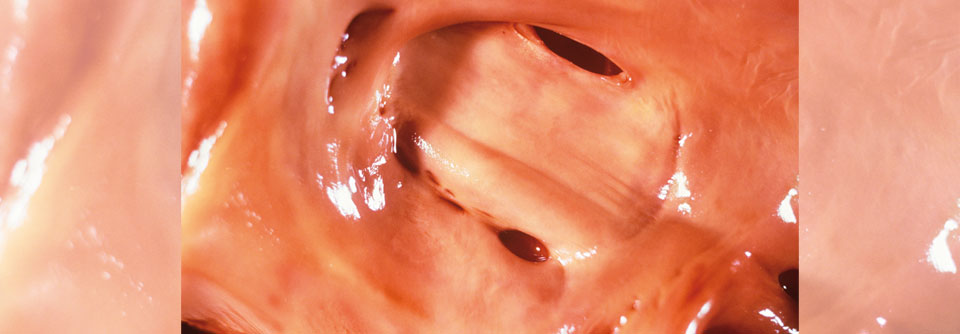
Bei vielen angeborenen Herzfehlern finden sich arrhythmogene Substrate. Und die Operationen setzen mit Narben, Nähten und Patches iatrogen noch eins drauf. „Wir haben bis heute keine systematische Strategie zur Arrhythmieprävention bei der Operation oder Reoperation angeborener Herzfehler“, kritisierte Dr. Hebe. Eine Möglichkeit wäre, gezielt Kryoläsionen im Herzmuskel zu platzieren. Hinzu kommt die hohe Individualität der Herzfehler und der operativen Eingriffe. Da Operationsberichte vielfach nicht mehr zu bekommen sind, ist kaum noch nachzuvollziehen, was genau gemacht wurde. Die OP-Technik scheint das Arrhythmierisiko aber nicht wesentlich zu beeinflussen. Anders das Alter des Patienten: Deshalb versuchen die Kardiochirurgen heute, so früh wie möglich zu operieren. Durch diese komplexe Gemengelage kann auf individueller Ebene ein Mix verschiedener Arrhythmien entstehen: ein Nebeneinander bradykarder und tachykarder ventrikulär und supraventrikulär getriggerter Störungen. Atriale Tachykardien stellen bei EMAH die häufigste Rhythmusstörung dar. Jeder Zweite, der den 20. Geburtstag überlebt, wird eine solche Arrhythmie entwickeln. Und diese ist „nicht per se benigne“, betonte Dr. Hebe. Betroffene haben ein deutlich erhöhtes Risiko, ventrikuläre Arrhythmien zu entwickeln. Je nach Situation sind die kardialen Kompensationsmöglichkeiten durch eingeschränkte ventrikuläre Funktion und Koronarreserve sowie Klappen- und/oder Gefäßstenosen bzw. -insuffizienzen reduziert. Die Therapieprinzipien sind – abgesehen von der Reoperation – die gleichen wie bei Erwachsenen ohne angeborenen Herzfehler. Antiarrhythmika punkten zwar mit ihrer Multisubstratwirkung, sind aber aufgrund ihrer vielfältigen unerwünschten Effekte gerade bei EMAH langfristig keine attraktive Option. Nicht zuletzt deshalb befinden sich Katheterablationen auf dem Vormarsch.Neue Wege mit neuen Substanzen
Rechter Ventrikel kann weniger kompensieren
Die ersten Zeichen lassen sich schon in jungen Jahren nachweisen, und die Überlebenschancen stehen noch schlechter als bei anderen Herzinsuffizienten. Entsprechend früh heißt es gegensteuern. Der linke Ventrikel bezieht seine Kraft aus den drei Muskellagen. Der rechte Ventrikel besteht aus zwei Schichten, er muss sich vor allem auf die Längsfaserkontraktion verlassen. Das erklärt die geringere Pumpkraft und die geringere Toleranz bei steigender Nachlast.BNP und NT-proBNP zur Diagnostik heranziehen
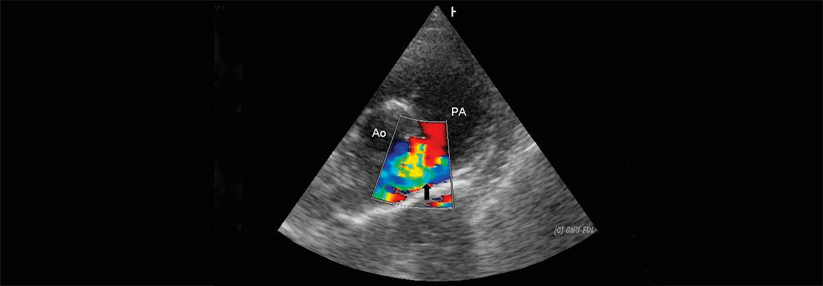
Bei EMAH fällt anfangs vor allem die hämodynamische Belastung ins Gewicht. Infolge der Funktionsverschlechterung setzen dann autonome Dysregulation und neuroendokrine Aktivierung ein, zu erkennen am Anstieg von natriuretischen Peptiden, Endothelin, Noradrenalin und RAS-Mediatoren. Dieser laborchemische Anstieg korreliert gut mit der NYHA-Klasse. BNP und NT-proBNP können also auch bei EMAH zur CHF-Diagnostik herangezogen werden. Hinsichtlich Pathophysiologie, Behandlungsindikationen und Verlauf einer Herzinsuffizienz bei EMAH sieht die Leitlinie zahlreiche Evidenzlücken. Orientierung in der Therapie gibt ein Positionspapier der ESC.2 Demnach sollten hämodynamisch wirksame Residuen der kongenitalen Erkrankung beseitigt sein, wenn man sich der CHF widmet. Bei fehlenden Symptomen und normaler systolischer Ventrikelfunktion reicht ein regelmäßiges Follow-up. Symptomatische Patienten sind Kandidaten für eine medikamentöse Therapie, vor allem wenn erhöhte natriuretische Peptide eine überproportionale Belastung des Herzmuskels anzeigen. Die Behandlung folgt denselben Prinzipien wie Erwachsenen ohne angeborenen Herzfehler. Das Positionspapier gibt noch differenziertere Empfehlungen je nach Art des Herzfehlers. „Diese Empfehlungen basieren aber im Wesentlichen auf Expertenmeinung und leider auf nicht viel Evidenz“, bedauerte Prof. Maack. „Die Durchführung größerer Therapiestudien ist sicher notwendig.“1. Baumgartner H et al. Eur Heart J 2021; 42: 563-645; DOI: 10.1093/eurheartj/ehaa554
2. Budts W et al. Eur Heart J 2016; 37: 1419-1427; DOI: 10.1093/eurheartj/ehv741
Kongressbericht: DGK Herztage 2021