Studie zur Arzneimittelversorgung zeigt Vorteile für die Krebstherapie im EU-Vergleich
 Im Vergleich zu anderen EU-Ländern ist Deutschland an der Spitze, wenn es um den Zugang zu onkologischen Medikamenten geht.
© iStock/Floortje
Im Vergleich zu anderen EU-Ländern ist Deutschland an der Spitze, wenn es um den Zugang zu onkologischen Medikamenten geht.
© iStock/Floortje
Das Wissenschaftliche Institut der PKV (WIP) verdeutlicht in der Studie „Arzneimittelversorgung der Privatversicherten 2020, Zahlen, Analysen, PKV-GKV-Vergleich“, dass es sich bei gut jedem vierten Arzneimittel (27,2 %), das Privatversicherten verordnet wird, um ein noch patentgeschütztes und damit relativ junges Präparat handelt. Bei gesetzlich Versicherten liegt der Anteil nur bei 6,6 %. Die GKV wird vom WIP deshalb als „Kostendämpfer“ gesehen, wohingegen die PKV als „Innovationsmotor“ beschrieben wird.
Gesetzlich Versicherte würden auch in acht von zehn Verordnungen (80,5 %) ein Generikapräparat erhalten. Bei Privatversicherten sei dies nur bei vier von zehn Verordnungen (41,2 %) der Fall. Die Differenzen seien die Folge der vielfältigen Steuerungsinstrumente der GKV zur Kostendämpfung.
Medikamente hier schneller einsetzbar als im EU-Mittel
Die Studie untermauere die wichtige Funktion der PKV bei der Versorgung mit innovativen Medikamenten, erklären die Privatversicherer in einer Pressemitteilung zufrieden. Die Vorreiterrolle trage zugleich dazu bei, dass innovative Krebsmedikamente in Deutschland sehr viel schneller verfügbar seien als im EU-Durchschnitt, heißt es weiter.
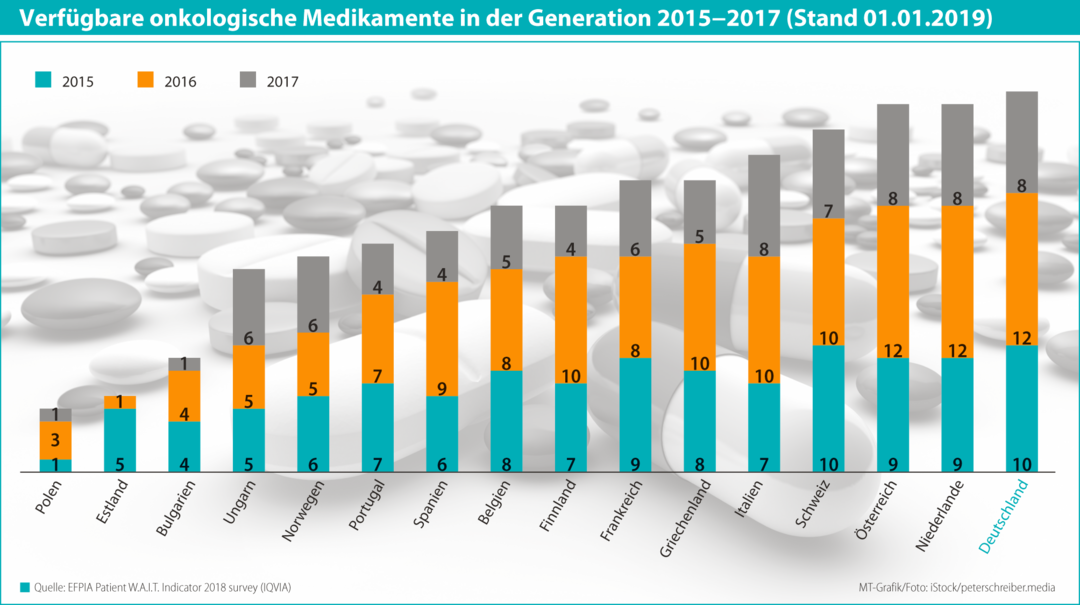
In einem Sonderkapitel der Studie wird der Zugang zu onkologischen Medikamenten im europäischen Vergleich näher beleuchtet. Deutlich werden erhebliche Unterschiede in der Zeitspanne zwischen der Zulassung eines Medikamentes durch die europäische Zulassungsagentur EMA und dem Inverkehrbringen auf den jeweiligen nationalen Märkten.
Demnach stehen onkologische Medikamente hierzulande bereits 82 Tage nach Zulassung für die Patienten und Ärzte zur Verfügung, der EU-Durchschnitt liegt dagegen bei 445 Tagen. Deutschland steht beim schnellen Zugang an der Spitze der EU-Länder vor den Niederlanden (163 Tage), Österreich (198), Finnland (232). Estländische Patienten warten fast 1000 Tage bis zur nationalen Verfügbarkeit. Von den 2015 bis 2017 in Europa zugelassenen 31 neuen onkologischen Wirkstoffen stehen derzeit in Deutschland 30 für die Patienten zur Verfügung. In anderen Staaten der Union ist die schnelle Verfügbarkeit dagegen z.T. stark eingeschränkt. Als Ursache sieht das WIP: „In allen anderen europäischen Ländern werden in der Versorgung teilweise deutlich weniger der neu zugelassenen onkologischen Medikamente vom Erstattungssystem erfasst und können deshalb in der Therapie nicht eingesetzt werden.“ In Polen stehen deshalb nur fünf dieser Medikamente aus 2015–2017 zur Verfügung, in Frankreich 23, in Österreich und Holland allerdings jeweils 29.
Auch Attraktivität des Pharmamarktes zählt
Von den seit dem Jahr 2000 durch die EMA zugelassenen 134 Orphans sind 134 in Deutschland verfügbar, 133 erstattungsfähig. „Diese Marktdurchdringung erreicht kein anderes europäisches Land“, so das WIP. Beispielsweise liege die Quote in Spanien nur bei 54,2 % und in Italien bei 87,4 %. Als eine wesentliche Ursache für die Unterschiede zwischen den EU-Ländern werden Besonderheiten der nationalen Regulierungssysteme herausgearbeitet. In einer Reihe von Ländern seien die Medikamente erst verfügbar, wenn sie ein teils langwieriges Health Technology Assessment (HTA) durchlaufen hätten. In Deutschland dagegen seien die Medikamente bereits vor Abschluss der Kosten-Nutzen-Bewertung durch den Gemeinsamen Bundesausschuss (G-BA) auf dem Markt und in der Erstattung. Als Vorteil für Deutschland gesehen wird auch die Attraktivität des Pharmamarktes für die forschenden Pharmaunternehmen sowie die sehr gute medizinische Infrastruktur, die bei vielen neuen onkologischen Präparaten oftmals unerlässlich sei. Die Europäische Kommission habe die Problematik der sehr unterschiedlichen Verfügbarkeit erkannt und strebt eine Vereinheitlichung der Prozesse auf EU-Ebene an, schreibt das WIP. Es gelte nun, diesen Prozess und seine möglichen Auswirkungen zu beobachten.Quelle: Medical-Tribune-Bericht