Nutzenbewertung Flexiblere Bewertung, aber auch zwei ganz große Rückschritte
 Bei der Zusatznutzenbewertung von Medikamenten gegen seltene Erkrankungen und kleine Patientengruppen wird fehlende Evidenz besonders deutlich.
© Ikhsan – stock.adobe.com
Bei der Zusatznutzenbewertung von Medikamenten gegen seltene Erkrankungen und kleine Patientengruppen wird fehlende Evidenz besonders deutlich.
© Ikhsan – stock.adobe.com
Wie der unparteiische Vorsitzende des Gemeinsamen Bundesausschusses (G-BA)Prof. Josef Hecken berichtet, wurde in der Nutzenbewertung bei kleinen Patientengruppen „eine relativ bemerkenswerte Lernkurve hingelegt“. Man sei in einigen Bereichen flexibler geworden, u.a. durch die „Anwendungsbegleitende Datenerhebung“ (AbD), die den Instrumentenkasten jetzt erweitere. Am Anfang sei der G-BA noch dem Postulat der randomisierten, kontrollierten Studien (RCT) nachgelaufen.
Allerdings hat es laut Prof. Hecken im letzten Jahr auch zwei ganz große Rückschläge gegeben: „Der erste Rückschlag ist das GKV-Finanzstabilisierungsgesetz (GKV-FinStG), in dem ganz banal im §130 b durch den Bundesminister und den Deutschen Bundestag bestimmt worden ist, dass in Zukunft kein Zusatznutzen für einen neuen Wirkstoff in der Bewertung durch den G-BA zwangsweise Abschläge gegenüber den Kosten der zweckmäßigen Vergleichstherapie (...) nach sich zieht.“ Damit würden im Prinzip Innovationen marginalisiert, nicht nur bei chronischen Krankheiten, sondern auch in hoch innovativen Therapieverfahren. Preisabschläge könnten letztendlich dazu führen, dass ein Wirkstoff vom Markt genommen werde, so Prof. Hecken. „Der zweite Punkt, der uns ganz, ganz schwer ins Kontor geschlagen hat, ist das berühmte ,Solisten-Urteil‘“.
Off-Label-Therapie darf keine Vergleichstherapie sein
Das Bundessozialgericht hatte im Februar aus der Sonderregelung für Orphans im §35 a SGB V die Schlussfolgerung gezogen, dass Solisten (Wirkstoffe ohne therapeutische Alternative), in der Nutzenbewertung nicht mehr mit Arzneimitteln im Off-Label-Use verglichen werden dürften. Dieser Off-Label-Use, der innerhalb der letzten zehn Jahre – verklausuliert unter der Wortschöpfung „Therapie nach Maßgabe des Arztes unter Beachtung des Zulassungsstatus“ – sei de facto anerkannt und er stelle in vielen onkologischen Bereichen fast die Regel der Versorgung in fortgeschrittenen Therapielinien dar. Nun könne dieser aber auch nicht mehr wie bisher „durch die Hintertür“ als zweckmäßige Vergleichstherapie anerkannt werden, beklagt der G-BA-Vorsitzende. Damit blieben zum Vergleich nur Best-Supportive-Care (BSC) mit einem gewissen therapeutischen Anspruch oder irgendwelche Alttherapien, die ärztlich haftungsrechtlich möglicherweise als herbe Fehlbehandlung gelten. „Das hilft alles nicht, um in fortgeschrittenen Therapien bei kleinen Patientengruppen mit neuen Wirkstoffen adäquat umzugehen“. In der Vergangenheit, sagte Prof. Hecken, habe es in §35 auch noch eine Öffnungsklausel für Fälle ohne Zusatznutzen gegeben. Man habe über die Kosten der zweckmäßigen Vergleichstherapie hinausgehen können. Doch „auch dieses Schlupfloch, das ich mühselig unter Herrn Gröhe (red. Anm.: ehem. Bundesgesundheitsminister) in das Gesetz eingepflegt hatte, ist uns jetzt von Herrn Lauterbach genommen worden.“ Auch das führe zu großen Problemen in der Nutzenbewertung. Für die Versorgung müsse man deshalb gemeinsam auf Öffnungen im Gesetz drängen.
Orphans kommen oft relativ problemlos durch Verfahren
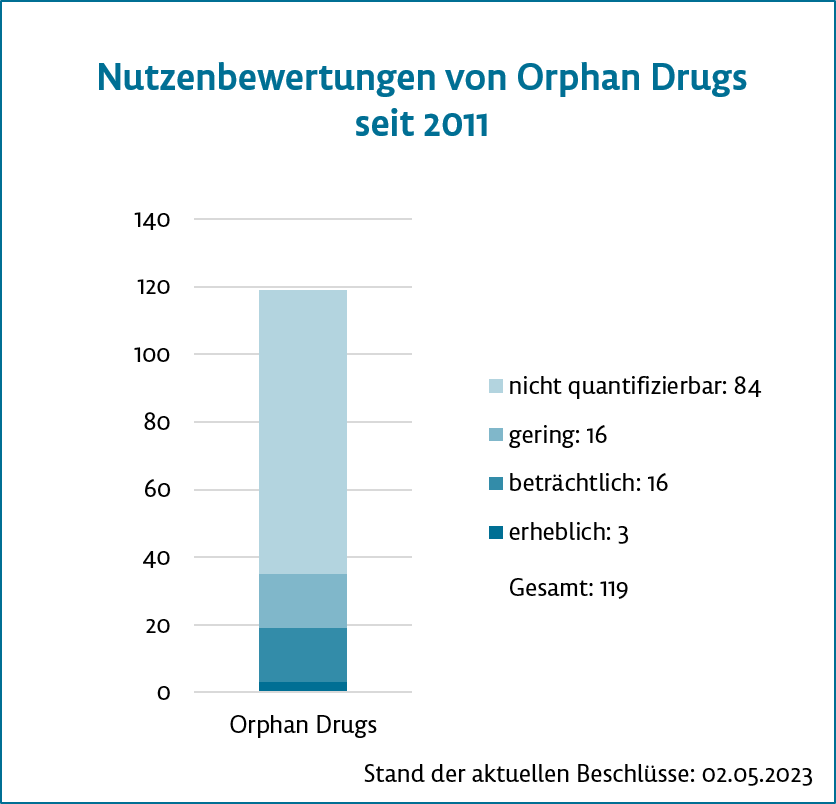
Laut Prof. Hecken kommen Orphans unter einer Umsatzschwelle von 30 Mio. Euro pro Jahr recht problemlos durch die Zulassungsverfahren, weil bei einem neuen Wirkstoff der Zusatznutzen fiktiv als belegt gilt. Selbst dann, wenn keine ausreichende Evidenz für eine Nutzenbewertung vorliege, bekomme der Wirkstoff immer noch einen nicht quantifizierbaren Zusatznutzen zugesprochen. Damit sei die Erstattung „eigentlich relativ safe“ und ebenso der Einsatz in der real existierenden Patient:innenversorgung. Es habe viele Jahre gegeben, in denen mehr Orphans als andere neue Wirkstoffe bewertet wurden. Jetzt seien reguläre Zulassungen in der Überzahl (aktueller Stand siehe Grafik).
Der Zusatznutzen ist bei kleinen Patient:innengruppen wegen schwacher Evidenz oftmals nicht quantifizierbar. Selbst bei Wirkstoffen, wo die fiktive Zulassung wegen Überschreiten der Umsatzschwelle nicht mehr möglich ist, habe sich die Evidenzbasis nicht verbessert, bemängelt Prof. Hecken. Das liege daran, dass in vielen Fällen eben keine Evidenz in der Anwendung generiert werde. Somit konnten auch 50 % jener Wirkstoffe, die nach der ersten in eine erneute Bewertung kamen, nach einer AbD ein Zusatznutzen nicht zugesprochen werden.
Als Grund für fehlende belastbare Evidenz nennt Prof. Hecken Datenlücken aufgrund von
- einarmigen, nicht vergleichenden Studien,
- Studien, die zu kurz dauern, um aussagekräftige finale Ergebnisse in relevanten Endpunkten zu erzielen,
- Studien, die monokausal auf einen Endpunkt, z. B. Mortalität, fokussiert sind,
- Studien mit vom Anwendungsgebiet abweichenden Populationen.
Dass man auch im Bereich seltener Erkrankungen und kleiner Patient:innengruppen vernünftige Daten generieren könne, zeigten aber Fälle, in denen ein beträchtlicher oder sogar einen erheblicher Zusatznutzen vergeben wurde. Das hängt laut Prof. Hecken aber teilweise auch damit zusammen, dass dramatische Effekte imstande sind, Evidenzlücken zu kompensieren.
Um Evidenzlücken zu schließen, müssten sich pharmazeutische Unternehmen rechtzeitig darüber Gedanken machen, „wie der Platz des Arzneimittels in der Therapiekaskade bei verschiedenen Anwendungsgebieten und dann in verschiedenen Stadien definiert werden soll“, so der G-BA-Vorsitzende. Nur so lasse sich ganz speziell Evidenz generieren, die man dann möglicherweise auch auf andere Indikationen übertragen könne. Unternehmen sollten außerdem parallel zu den Studien indikationsspezifische Register unterstützen, welche eine AbD ermöglichten.
Noch allerdings sei bezüglich der Register keinerlei Bereitschaft bei pharmazeutischen Unternehmen zu sehen, kritisiert Prof. Hecken. Er sieht somit bei AbD noch große Optimierungspotenziale. Man müsse schneller und besser werden, um in Zusammenarbeit mit den Zulassungsbehörden und den pharmazeutischen Unternehmern und durch frühe Beratungen – vor dem Start von Studien – den Fokus auf die Register zu lenken. Damit ließen sich entsprechende Daten nach ein, zwei oder drei Jahren für die Nutzenbewertung heranziehen und die Therapiesteuerung ließe sich mit gesicherter Evidenz unterlegen.
Aus Sicht der Patientinnen und Patienten seien die Methodenbewertung und die Bewertung von Arzneimitteln hinsichtlich des Nutzennachweises von ganz zentraler Bedeutung, betont Dr. Martin Danner, Bundesgeschäftsführer der BAG Selbsthilfe. Eine ganz wichtige Errungenschaft sei hierbei das Messen des patient reported outcomes (PRO), speziell auch der Lebensqualität. Es bedürfe jedoch eines weiteren Entwicklungsprozesses, um die singulären Outcomes noch besser zu erfassen, so der Patientensprecher. Er geht davon aus, dass in Zukunft interdisziplinär daran gearbeitet werden muss.
Eine positive Einschätzung kommt auch vom Medizinischen Leiter der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie, Prof. Dr. Berhard Wörmann. In 60 % der Nutzenbewertungsverfahren in der Hämatologie und Onkologie gebe es valide Daten, in 90 % Daten zur Lebensqualität. Das sei schon ein guter Schritt nach vorne. „Trotzdem glaube ich, dass die Instrumente zu grob sind.“ Wenn nur alle drei Monate Daten erhoben würden, dann würde ganz viel eben auch nicht erhoben. Daten müssten länger erfasst werden, auch in eine Rezidivtherapie hinein, um zu sehen, wie die Lebensqualität beeinflusst wird und wie die Patient:innen die Therapie erleben. „Deswegen glaube ich, dass da noch ein deutliches Potenzial ist, um noch mehr von diesen Parametern in den Nutzwert reinzubringen“, so Prof. Wörmann.
Er könne das nur unterstützen, bemerkt Prof. Hecken: „Verfeinerung ist wichtig.“ Er berichtete über vorhandene Anreize für die pharmazeutischen Unternehmer, damit diese auch in internationalen Studiendesigns die hierzulande geforderten Kriterien erfüllen.
In drei G-BA-Beschlüssen sei allein aus der Verbesserung von PROs der Zusatznutzen abgeleitet worden, in einem Fall sogar ein beträchtlicher Zusatznutzen: „Wir hatten keinen Unterschied im Gesamtüberleben. Wir hatten keinen Unterschied beim Progress“, so Prof. Hecken. „Nur den Patienten ging es besser unter dieser Therapie.“ Für die Erkrankten sei am Ende des Tages vielfach entscheidender, wie es ihnen auf dem Weg bis zum finalen Endpunkt gehe und nicht sechs Wochen später.
Quelle: DGHO-Frühjahrstagung