Melanom: Immuntherapie vor und nach der OP
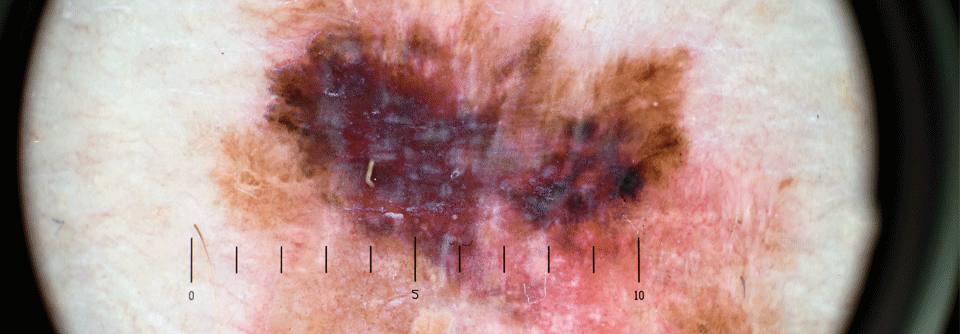
 Klinische Daten bestätigten die Effektivität der neoadjuvanten Immuntherapie als Standardbehandlung für das Melanom mit Makrometastasen.
© StudioLaMagica – stock.adobe.com
Klinische Daten bestätigten die Effektivität der neoadjuvanten Immuntherapie als Standardbehandlung für das Melanom mit Makrometastasen.
© StudioLaMagica – stock.adobe.com
Schon vor der NADINA-Studie hatte die Phase-2-Studie SWOG S1801 die Ära der neoadjuvanten Immuntherapie beim resektablen Melanom im Stadium IIIB und IV eingeläutet. Verglichen worden war eine Therapie mit drei Zyklen Pembrolizumab vor und 15 Zyklen nach der Operation mit der rein adjuvanten Gabe von 18 Zyklen des CPI. Prof. Dr. Vernon K. Sondak vom Moffitt Cancer Center in Tampa stellte Ergebnisse von Analysen nach mindestens drei Jahren Beobachtungsdauer vor.1
Die Drei-Jahres-Rate des ereignisfreien Überlebens (EFS) betrug – harmonisiert mit den EFS-Kriterien der NADINA-Studie – 68 % mit perioperativem Pembrolizumab und 56 % in der Kontrollgruppe (HR 0,67; 95%-KI 0,42–0,94; p = 0,02). Das Gesamtüberleben verlängerte sich durch die drei neoadjuvanten Zyklen ebenfalls, mit Drei-Jahres-Raten von 84 % vs. 73 % (HR 0,66; 95%-KI 0,42–1,02; p = 0,06). Einen günstigen Verlauf nach perioperativer Immuntherapie hatten vor allem Patient:innen mit einem kompletten oder einem fast kompletten pathologischen Ansprechen (pCR, pNearCR).
Was wurde in der NADINA-Studie untersucht?
In der NADINA-Studie wurde aufgrund eines signifikanten EFS-Vorteils bereits nach 10,6 Monaten medianer Beobachtungsdauer die neoadjuvante kombinierte Immuntherapie beim resektablen Melanom im Stadium III etabliert. Eine adjuvante Behandlung erfolgte nur bei partiellem oder Nichtansprechen auf die neoadjuvante Therapie nach dem pathologischen Befund im Resektat.
Im Update der NADINA-Studie betrug die Zwei-Jahres-EFS-Rate 77,3 % in der Gruppe mit zwei neoadjuvanten Zyklen Ipilimumab plus Nivolumab und 55,7 % bei alleiniger adjuvanter Nivolumabtherapie, berichtete Dr. Minke W. Lucas vom Niederländischen Krebsinstitut in Amsterdam.2 Patient:innen mit pCR profitierten hinsichtlich des rezidivfreien Überlebens (RFS) nach zwei Jahren von der Neoadjuvanz am meisten, mit einer RFS-Rate von 95,1 % (vs. 48,4 % in der Gruppe der Non-Responder:innen).
Diejenigen, die pathologisch nur partiell oder nicht angesprochen hatten und deren Tumoren eine BRAFV600E-Mutation aufwiesen, zogen in der Adjuvanz den größten Nutzen aus Dabrafenib plus Trametinib. Die Zwei-Jahres-RFS-Rate betrug dann 67,2 %. Diejenigen, die Nivolumab erhalten hatten – also mit Tumoren mit anderen BRAF-Mutationen bzw. wildtypischen Melanomen –, erreichten nur eine Rate von 37,7 %.
Therapieeskalation macht keinen Unterschied
Prof. Dr. Tara C. Mitchell von der Universität von Pennsylvania in Philadelphia stellte eine Studie vor, in die Personen mit Stadium-III-Melanom einschlossen waren.3 Die Teilnehmenden erhielten eine Dosis neoadjuvantes Nivolumab und wurden dann operiert. Diejenigen mit majorem pathologischem Ansprechen (MPR) bekamen adjuvantes Nivolumab. Personen, die keine MPR erreichten, wurden 1:2 zu Nivolumab oder Nivolumab + Ipilimumab randomisiert.
In dieser Kohorte machte die Hinzunahme von Ipilimumab nach zwei Jahren weder für das RFS noch das OS einen Unterschied. Allerdings war die Toxizität bei intensivierter adjuvanter Therapie erhöht.
Neoadjuvante Immuntherapie ist weiterhin Standard
Die drei Studien beantworten einige wichtige praxisrelevante Fragen zur Therapie des Melanoms mit Makrometastasen, erläuterte Diskutant Prof. Dr. Dr. Bart Neyns von der Freien Universität von Brüssel.4 Die neoadjuvante Immuntherapie sollte nach den Ergebnissen der Studien SWOG S1808 und NADINA wirklich der Standard sein, wenn Melanompatient:innen bei Diagnose resektable Makrometastasen aufweisen.
Der Unterschied in der EFS-Rate zur alleinigen adjuvanten Immuntherapie betrug in der SWOG-S1808-Studie nach zwei Jahren 15 %, in der NADINA-Studie 21 %. Die etwas bessere Wirksamkeit einer kombinierten neoadjuvanten Immuntherapie gegenüber einer Monotherapie mit einem PD(-L)1-Antikörper geht mit höherer Toxizität einher – das muss mit den Betroffenen besprochen werden.
Wünschenswert wäre eine Verkürzung der Adjuvanz bei gutem pathologischem Ansprechen auf die neoadjuvante Behandlung. Erreichen die Erkrankten eine MPR nach neoadjuvantem Ipilimumab plus Nivolumab, scheint das nach der NADINA-Studie möglich, meinte Prof. Neyns. Das rezidivfreie Überleben lag nach zwei Jahren in dieser Gruppe bei 95,1 %. Bei nahezu komplettem und partiellem Ansprechen ist das nach der NADINA-Studie unklar und es sind mehr Daten für die Subgruppe nötig.
Frage nach der Länge der Adjuvanz bislang ungeklärt
Nach neoadjuvanter Monotherapie mit einem PD(-L)1-Antikörper ist und bleibt ein Jahr Adjuvanz unabhängig vom pathologischen Ansprechen Standard. Es sollte aber prospektiv geprüft werden, wie lange die adjuvante Immuntherapie bei einem majoren pathologischen Ansprechen erfolgen muss, findet Prof. Neyns.
Analysen aus den drei Studien geben erste Hinweise auf Biomarker für eine weitere Personalisierung der neoadjuvanten Therapie. Prof. Mitchell berichtete, dass T-bet3-positive, melanomspezifische CD8+ T-Zellen mit dem Ansprechen korrelierten. Sie könnten als blut- oder tumorbasierter Biomarker eine Rolle spielen.
In NADINA waren die Interferon-g-Signatur, die PD-L1-Expression und die Tumormutationslast zu Studienbeginn im neoadjuvanten Arm mit dem EFS assoziiert, die Interferon-g-Signatur und die PD-L1-Expression auch mit dem EFS im adjuvanten Arm. Alle drei Biomarker differenzierten in beiden Gruppen mit günstiger und ungünstiger Prognose. Einen Einfluss auf die Therapieentscheidung haben solche Marker aber bislang nicht. Wird nach neoadjuvanter Immuntherapie kein MPR erreicht, sollte bei Vorliegen einer BRAFV600E-Mutation adjuvant vorrangig eine kombinierte BRAF-MEK-Hemmung erfolgen.
Die adjuvante duale Checkpoint-Inhibition sollte nach unzureichendem Ansprechen auf eine neoadjuvante Immuntherapie nach den von Prof. Mitchell vorgestellten Daten keine Rolle spielen, betonte Prof. Neyns. Ob die neoadjuvante Immuntheapie beim Melanom mit resektablen Makrometastasen das OS verbessert, ist bislang noch nicht sicher geklärt. Die Studie SWOG S1808 gibt Anlass zu vorsichtigem Optimismus, in NADINA müssen entsprechende Langzeitdaten abgewartet werden.
Quellen:
1. Sondak VK für Patel SP. ESMO Congress 2025; Abstract 1601O
2. Lucas MW. ESMO Congress 2025; LBA57
3. Mitchell T für Miura J. ESMO Congress 2025; Abstract 1604O
4. Neyns B. ESMO Congress 2025; Invited Discussant 1601O, LBA57, 1604O
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).