Muskuloskelettale Schmerzen – ernst nehmen und topisch mit NSAR behandeln
 © Kaspars Grinvalds – stock.adobe.com
© Kaspars Grinvalds – stock.adobe.com
Muskuloskelettale (MSK) Schmerzen und deren zugrunde liegende Erkrankungen zählen weltweit zu den führenden Ursachen einer teils stark eingeschränkten gesundheitsbezogenen Lebensqualität.1,2 Laut der aktuellen Global-Burden-of-Disease-Studie zählen Kreuzschmerz, Nackenschmerz, Arthrose und andere MSK-Erkrankungen und die damit verbundenen Schmerzen zu den führenden Ursachen einer beeinträchtigten Gesundheit.1 Dabei spielen nicht nur physische Einschränkungen eine Rolle, auch die psychischen, sozialen und sozioökonomischen Belastungen können erheblich sein.2-4
Derartige Beeinträchtigungen betreffen vor allem Menschen mit chronischen MSK-Schmerzen, die sich in der Regel über einen Zeitraum länger als drei bis sechs Monate manifestieren, häufig jedoch über Jahre hinweg.5 Die Ursache ist oft eine Arthrose der Knie-, Hüft- und Handgelenke.6 Auch chronische Kreuz- oder Nackenschmerzen sind hier zu nennen.5 Abzugrenzen sind akute MSK-Schmerzen mit einer Dauer von in der Regel weniger als drei Monaten bei stetig abnehmender Schmerzintensität.5 Zu den häufigen Ursachen zählen hier Sportverletzungen in Form von Verstauchungen oder mechanische Überbeanspruchungen wie Zerrungen oder Sehnenentzündungen,7 aber auch degenerative Prozesse wie z.B. die Arthrose können durch Schübe akute MSK-Schmerzen hervorrufen.8 Dieser Akutschmerz kann ebenso wie bei der chronischen Schmerzmanifestation zusätzlich zur physischen auch relevante psychische und soziale Folgen nach sich ziehen.9
Die Prävalenz von MSK-Schmerzen und die damit verbundenen Belastungen für die Betroffenen selbst und für die Gesellschaft insgesamt werden in den kommenden Jahren noch steigen.10 Dies hängt in erster Linie mit dem demographischen Wandel und dem daraus resultierenden steigenden Anteil an Menschen mit degenerativen und chronischen Erkrankungen zusammen. Bereits gegenwärtig verursachen Kreuzschmerz und andere chronische Schmerzerkrankungen relevante Kosten im deutschen und europäischen Gesundheitswesen.3,4 So lagen einer Umfrage aus Deutschland aus dem Jahr 2005 mit 9267 Teilnehmern zufolge die durchschnittlichen jährlichen, direkten und indirekten Kosten im Zusammenhang mit Kreuzschmerzen pro Patient bei 1322 Euro.4 Hinzu kommt eine Zunahme der Prävalenz wichtiger Risikofaktoren für MSK-Schmerzen. Der Anteil der Erwachsenen mit dem Risikofaktor Adipositas beispielsweise hat sich in Deutschland zwischen 2000 und 2015 auf knapp 25 % verdoppelt.11,12
Vor diesem Hintergrund ist das Ziel dieses Beitrags zum einen, die Notwendigkeit einer Therapie von MSK-Schmerzen zu unterstreichen. Zum anderen soll praxisrelevantes Wissen für eine unkomplizierte Behandlung mit topischen NSAR vermittelt werden, da diese einen wichtigen Bereich des Selbstmanagements und damit der Selbstwirksamkeit der Patienten darstellt.
1. Physische und emotionale Auswirkungen von MSK-Schmerz
Ein Aspekt, der in der ärztlichen Praxis im Kontext von MSK-Schmerzen nicht unterschätzt werden sollte, sind Beeinträchtigungen des emotionalen Wohlbefindens und der Lebensqualität allein durch die Schmerzen selbst. Einen Eindruck von deren Tragweite gibt eine kombinierte Analyse dreier weltweit durchgeführter Querschnittsumfragen mit insgesamt 28 861 erwachsenen Personen – 2419 davon aus Deutschland.2,13 Diese Personen hatten mindestens einmal von MSK-Schmerzen berichtet. Ermittelt wurde anschließend der Prozentanteil jener Personen, für die der Schmerz relevante Auswirkungen auf die physischen und psychischen Aspekte ihres Gesundheitszustands sowie die Lebensqualität hatte. Bezogen auf die Teilnehmer aus Deutschland werteten durchschnittlich 49 % der Befragten ihre MSK-Schmerzen als eine substanzielle physische Beeinträchtigung – 67 % in Bezug auf die Dauer (mind. mehrere Stunden), 57 % bezogen auf die Schmerzfrequenz (mind. wöchentlich) und 24 % hinsichtlich der Schmerzintensität (mind. 7 Punkte auf der Schmerzskala 0 = kein Schmerz; 10 = maximaler Schmerz). 34 % der Befragten gaben eine relevante emotionale Beeinträchtigung an. Dies umfasste ein geringeres Selbstwertgefühl (Anteil 34 %), Angst vor Schmerzen (Anteil 27 %) sowie eine verminderte Fähigkeit, Freude zu empfinden (Anteil 42 %). Für 69 % der Befragten aus Deutschland hatten die MSK-Schmerzen auch negative Auswirkungen auf ihre Lebensqualität. Insgesamt schienen ähnlich viele Frauen wie Männer die Belastung durch MSK-Schmerzen als relevant zu beurteilen.2
Zusammenfassend unterstreichen die Ergebnisse dieser sehr großen Umfrage die therapeutische Relevanz des Zusammenhangs zwischen biologischen, psychischen und sozialen Faktoren bei MSK-Schmerzen. Dies findet sich auch in dem zugrunde liegenden biopsychosozialen Krankheitsmodell und Behandlungsansatz bei Schmerzen generell wieder.14 Daher spielen bei der Wahrnehmung und Bewertung von MSK-Schmerzen auch Faktoren eine Rolle, die auf den ersten Blick nicht wichtig zu sein scheinen: Bildungsstand, Einkommen, Persönlichkeitsakzentuierung, soziale Unterstützung und Komorbidität.15 So ist beispielsweise ein reziprokes Verhältnis zwischen chronischer Schmerzempfindung und depressiven Störungen beschrieben worden: Bei betroffenen Patienten ist eine Zunahme der Schmerzbelastung ein starker Prädiktor für eine Intensivierung einer depressiven Störung, und umgekehrt.16 In einer anderen Arbeit konnte gezeigt werden, dass eine stärkere soziale Unterstützung von Schmerzpatienten mit einer besseren persönlichen Bewertung ihrer gesundheitsbezogenen Lebensqualität einherging. Dies betraf verschiedene Dimensionen wie allgemeine Gesundheitswahrnehmung, mentale Gesundheit, soziale Funktionsfähigkeit und Vitalität.17
2. Patienten-Selbstmanagement
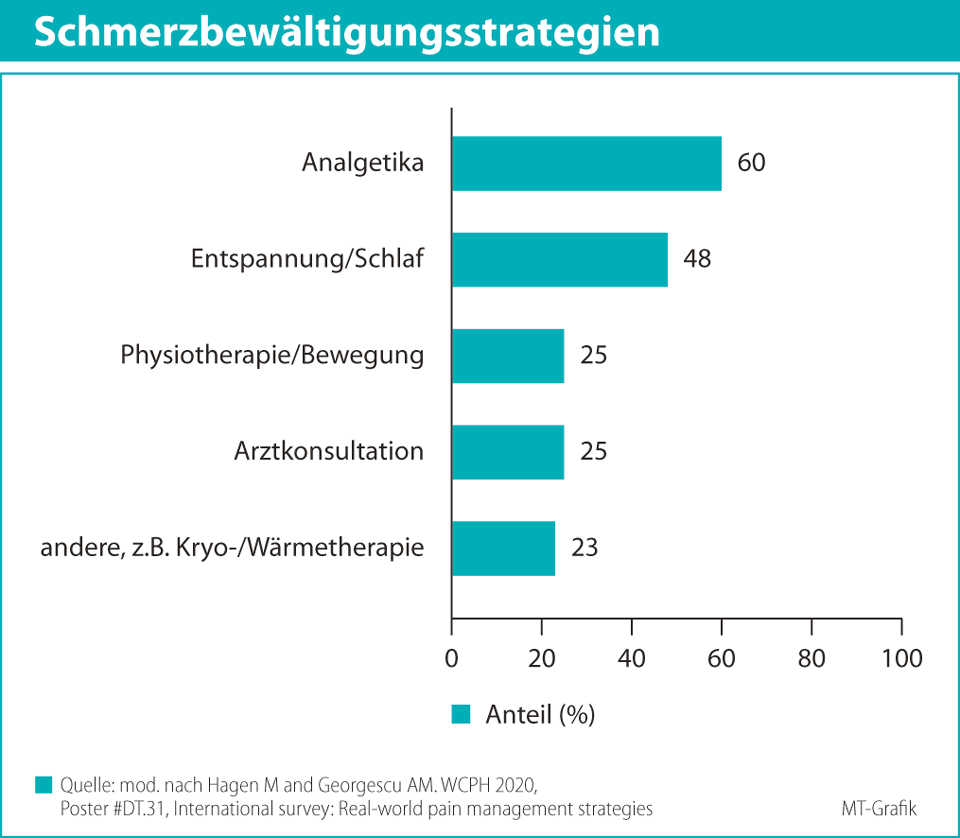
Das biopsychosoziale Krankheitsmodell ist ebenfalls auf die Therapie bei MSK-Schmerzen anwendbar, diese ist grundsätzlich multimodal und interdisziplinär. Eine wesentliche Rolle spielt dabei das Selbstmanagement der Patienten, das zur Selbstwirksamkeit beiträgt: Der behandelnde Arzt klärt hinsichtlich Selbstmedikation auf und unterstützt anleitend. Hilfreich dazu kann das Wissen sein, wie Menschen mit MSK-Schmerzen auf ihre Beschwerden reagieren. Informationen dazu liefern unter anderem die Ergebnisse einer Umfrage, die 2020 auf dem virtuellen 16. World Congress on Public Health vorgestellt wurden.18 An der Umfrage teilgenommen hatten 18 602 Erwachsene in gleicher Geschlechterverteilung. 83 % von ihnen litten mindestens einmal pro Jahr an Muskelschmerzen, 73 % an Gelenkschmerzen, v.a. Arthrose oder rheumatoider Arthritis, und 61 % an Schmerzen in Bändern, Sehnen oder Knochen. Es sei aber darauf hingewiesen, dass in diese Umfrage auch Personen mit anderen Schmerzformen, z.B. Kopfschmerz (84 %), Migräne (60 %) oder Bauchschmerzen (79 %), eingeschlossen waren.18 Im Hinblick auf das Selbstmanagement gaben 91 % der Befragten (n = 16 985) an, dass sie eigenständig eine Schmerzbehandlung durchführten. Dabei hatten Analgetika mit 60 % den größten Anteil (Abb. 1). Nicht zu unterschätzen sind allerdings auch nicht-medikamentöse Ansätze: 48 % der Befragten behandelten ihre Schmerzen mit körperlicher Entspannung bzw. Schlafen, 25 % verfolgten eine Bewegungstherapie (inkl. Dehnungsübungen oder Massage) und 23 % andere nicht-medikamentöse Ansätze wie eine Kryo- oder Wärmetherapie. Der Anteil der Befragten, die angaben, ärztlichen Rat aufzusuchen, lag bei lediglich 25 %, was umgekehrt bedeutet, dass 75 % der Betroffenen die Schmerzen ohne ärztliche Konsultation in Eigenregie behandeln, was prinzipiell kein Nachteil sein muss. Bevor sie pharmakologisch oder nicht-pharmakologisch intervenierten, warteten 53 % der Befragten mindestens mehrere Stunden oder Tage ab. Wesentliche Gründe dafür standen im Zusammenhang mit einer medikamentösen Therapie: 37 % der 10 329 Personen, die zu dieser Frage Angaben machten, standen einer Pharmakotherapie kritisch gegenüber. Jeder Fünfte fürchtete sich vor Nebenwirkungen oder Arzneimittelabhängigkeit. Ein Drittel gab an, den Schmerz vielmehr zu akzeptieren, statt ihn behandeln zu wollen. Allerdings gaben über drei Viertel (76 %) aller Befragten (n = 18 602) an, sich eine bessere Schmerzkontrolle zu wünschen.18 Vor allem dieser letzte Punkt weist darauf hin, dass es u.a. in der Therapie von MSK-Schmerzen noch Verbesserungspotenzial gibt. Zusammenfassend kann man festhalten, dass die vielen Betroffenen sich eine bessere Schmerzkontrolle wünschen, diese jedoch möglichst in Eigenregie durchführen möchten.3. NSAR in der Therapie der MSK-Schmerzen
Zusätzlich zum Patienten-Selbstmanagement sind in der multimodalen Therapie der MSK-Schmerzen die Physiotherapie, manuelle, komplementäre und psychosoziale Therapien sowie Interventionen mit nicht-verschreibungspflichtigen und verschreibungspflichtigen Analgetika hilfreich.14,19,20 In der initialen pharmakologischen Schmerztherapie von Erwachsenen zählen nicht-steroidale Antirheumatika (NSAR) als rezeptfreie Analgetika zu den Mitteln der Wahl, vor allem bei milden bis moderaten Schmerzen.21 Dies zeigt u.a. eine Übersichtsarbeit, die 114 internationale Leitlinien zu relevanten Schmerzentitäten (u.a. Arthrose und Kreuzschmerz) ausgewertet und zusammengefasst hat.21 Auch in deutschen Leitlinien zu verschiedenen Schmerzentitäten nehmen NSAR eine wichtige Position in der Behandlung ein. Die Deutsche Gesellschaft für Orthopädie und Orthopädische Chirurgie (DGOOC) empfiehlt in ihrer S2-Leitlinie zur Koxarthrose deren Einsatz, wenn andere Therapiemaßnahmen (z.B. Physiotherapie) lediglich eine inadäquate Schmerzlinderung bewirken.22 Bei Gonarthrose sprechen sich die S2-Leitlinienautoren der DGOOC ebenfalls für den Einsatz von NSAR aus, wobei allerdings unterstrichen wird, dass in diesem Fall eine topische Applikation der oralen Anwendung vor allem in Hinblick auf Nebenwirkungen vorzuziehen ist.23 In der S1-Handlungsempfehlung der Deutschen Gesellschaft für Allgemeinmedizin und Familienmedizin (DEGAM) zur Therapie des nicht-spezifischen Nackenschmerzes empfehlen die Autoren den kurzfristigen Einsatz von NSAR in der Akut- bzw. Subakutphase (0–3 Wochen bzw. 4–12 Wochen).24 Bei nicht-spezifischem Kreuzschmerz sollten gemäß Nationaler Versorgungsleitlinie NSAR zur Behandlung in der niedrigst wirksamen Dosierung und für so kurze Zeit wie möglich angewendet werden.25 Allerdings weisen die Autoren darauf hin, dass für die Anwendung von topisch applizierbaren NSAR bei dieser Schmerzentität kein positiver Wirksamkeitsnachweis gefunden wurde, da in der systematischen Recherche, die der Empfehlung zugrunde liegt, keine Studien zur Anwendung topischer NSAR bei nicht-spezifischen Kreuzschmerzen identifiziert werden konnten.253.1 Exkurs: Opioide
Aufgrund der Sorgen der Schmerzpatienten vor Nebenwirkungen und Abhängigkeit bei einer medikamentösen Intervention, soll an dieser Stelle auch deutlich auf die Langzeitanwendung von Opioiden bei chronischen, nicht-tumorbedingten Schmerzen eingegangen werden. Opioide sind im Laufe der letzten Jahre zunehmend in den Fokus der Aufmerksamkeit gerückt, vor allem bedingt durch die Opioid-Epidemie in den USA, die sich aufgrund einer Zunahme unkritisch verschriebener Opiate für Nicht-Tumorschmerz entwickelt hat. Sogenannte „Pain Doctors“ hatten das starkwirksame Opioid Oxycodon in großem Umfang verschrieben.26 Erfreulicherweise hat eine vergleichbare Entwicklung in Deutschland nicht stattgefunden. So konstatiert die Deutsche Schmerzgesellschaft e.V. in ihrer im Jahr 2020 aktualisierten Leitlinie zur Langzeitanwendung von Opioiden bei chronischen, nicht-tumorbedingten Schmerzen (LONTS), dass es in Deutschland aktuell keine Hinweise auf eine Opioidkrise gebe.26 Bei chronischem Rückenschmerz sehen die Leitlinienautoren einen möglichen Einsatz opioidhaltiger Analgetika nur bei unzureichendem Ansprechen auf nicht-medikamentöse Therapien.26 Für Patienten mit chronischem Arthroseschmerz sind Opioide gemäß LONTS nur nach dem Versagen nicht-medikamentöser Therapien und/oder der Wirkungslosigkeit bzw. Kontraindikationen anderer Analgetika und/oder einem nicht durchführbaren bzw. nicht gewünschten Gelenk- ersatz indiziert.26 Allgemein scheint jedoch gerade bei älteren Patienten mit MSK-Schmerzen eine Opioidgabe nur mit geringer analgetischer Wirkung und funktionaler Verbesserung bei gleichzeitig erhöhtem Nebenwirkungsrisiko einherzugehen.27 Zudem sind Opioide aufgrund ihrer besonders aufwendigen Rezeptierung von der Möglichkeit der Selbstmedikation ausgeschlossen. Gerade im Hinblick auf den Stellenwert des Selbstmanagements der Patienten mit MSK-Schmerzen und ihrer geringen Bereitschaft zur Arztkonsultation erweist sich der Einsatz von NSAR – vor allem für die kurzzeitige Behandlung – als sinnvoll.21 Auf Dauer eingenommene Opioide sind in der MSK-Therapie aus den oben genannten Gründen eher nachrangig einzuordnen. Entsprechend liegt der Fokus im Folgenden auf der medikamentösen Intervention mit rezeptfreien NSAR, die für eine unkomplizierte Selbstmedikation bei MSK-Schmerzen eingesetzt werden können.4. Topische oder orale NSAR?
NSAR bilden eine heterogene Gruppe von Pharmaka, die eine nicht-selektive, reversible Hemmung der Cyclooxygenasen COX-1 und COX-2 bewirken. Damit unterscheiden sie sich von den Coxiben, die (hoch-)selektiv COX-2 hemmen. COX-1 und COX-2 katalysieren die Synthese von Prostaglandinen und Leukotrienen. Eine durch Inhibition von COX-1 und COX-2 verminderte Prostaglandin-Synthese ist entscheidend für die antiinflammatorischen und analgetischen Wirkungen der NSAR.28 In der ärztlichen Praxis zu beachten ist, dass bei oraler und damit systemischer Gabe u.a. das Risiko für Komplikationen vor allem im oberen Gastrointestinaltrakt (z.B. Obstruktion, Blutung, Magengeschwür-Perforation) erhöht ist.29 Zurückzuführen ist dies auf eine konstitutive COX-1-Expression im Gastrointestinaltrakt und auf den zytoprotektiven Effekt, den Prostaglandine auf die Darmmukosa haben.28 COX-1- und COX-2-abhängige Prostaglandine sind außerdem von zentraler Bedeutung für die Regulation der vaskulären Homöostase.28 Dies spielt besonders bei Patienten mit kardiovaskulären Risikofaktoren bzw. Erkrankungen eine wichtige Rolle. Speziell die Hemmung von COX-2 wurde mit einem erhöhten kardiovaskulären Risiko assoziiert, was vor allem beim Einsatz von Coxiben relevant ist.28 Selektive COX-2-Hemmer sind bei kardiovaskulär Vorerkrankten kontraindiziert.30 Da Patienten mit MSK-Schmerzen, vor allem bei chronischer Manifestation, Risikofaktoren wie ein höheres Alter, kardiovaskuläre Komorbiditäten oder Begleitmedikation aufweisen, ist die Beachtung dieser Risiken einer systemischen NSAR-Applikation in der ärztlichen Praxis lebensnotwendig. So wurde in den USA von ca. 2000 Todesfällen pro Jahr berichtet, die im Zusammenhang mit schweren Komplikationen wie z.B. der Perforation eines Magengeschwürs bei regelmäßigem Einsatz von NSAR standen.31 Alternativ zur oralen Gabe besteht die Möglichkeit einer topischen Applikation von NSAR, vor allem in Form von Gelen oder Pflastern. Diese Applikationsform ist insbesondere bei den MSK-Schmerzen indiziert, bei denen primär das Ziel einer lokalen Analgesie verfolgt wird, wie es vor allem bei Sportverletzungen oder bei einer Monoarthrose der Fall ist.7 Aufgrund der zu erwartenden geringeren systemischen Exposition gegenüber einer oralen Gabe ist das Risiko für unerwünschte Ereignisse (UE) wie gastrointestinale Nebenwirkungen bei dieser Applikationsform verringert.7,32 Die Wirksamkeit hingegen scheint bei topischer Applikation von NSAR mit der einer oralen Applikation vergleichbar hoch, wie entsprechende direkte Vergleichsstudien bei Arthrose-Patienten gezeigt haben.324.1 Pharmakokinetische Aspekte bei topischen NSAR
Bei topischer Applikation von NSAR besteht eine zentrale Herausforderung darin, dass der Wirkstoff die Epidermis als Hautbarriere überwindet.33,34 Mit der Entwicklung von Pflastern, Gelen und anderen topischen Formulierungen wie Sprays werden verschiedene Strategien verfolgt, um die gewünschte Wirkstoffexposition lokal zu erzielen. Speziell zur Pharmakokinetik topischer NSAR liegen Ergebnisse aus präklinischen und kleineren klinischen Studien vor.34-42 So hatte beispielsweise eine kleine Studie mit 23 Probanden, die einen endoprothetischen Kniegelenkersatz erhalten sollten, gezeigt, dass bei kutaner Applikation von Diclofenac Diethylamin 1,16 % Gel (3 x täglich 80 mg) therapeutisch wirksame Konzentrationen in oberflächennahen Kompartimenten und periartikulärem Gewebe erreicht wurden.42 Die Studie kam überdies zu dem Schluss, dass eine maßgebliche direkte Penetration in tiefer gelegene Kompartimente des Kniegelenks ausgeschlossen werden konnte.42 Auch eine weitere kleine klinische Studie zur Wirkstoffpenetration von Diclofenac Diethylamin 2,32 % Gel (2 x täglich 4 g Gel entsprechend 74,4 mg Wirkstoff) bei 29 Patienten mit Gonarthrose ergab, dass bei einer 7-tägigen kutanen Applikation auch noch 12–15 Stunden nach der letzten Anwendung eine Wirkstoffkonzentration im Synovialgewebe und in der Synovialflüssigkeit oberhalb der Nachweisgrenze gemessen werden konnte.39 Bei kutaner Applikation von NSAR als Gelformulierung gibt es Hinweise, dass es zur Ausbildung eines Wirkstoffdepots in der Epidermis kommt.40 Dieses Depot scheint eine Reservoir-Funktion zu haben und so eine kontinuierliche Wirkstofffreisetzung zu ermöglichen.40 Wie stark die Penetration in das Zielgewebe ist, hängt von verschiedenen Faktoren ab, u.a. der Dosis, der Applikationsfrequenz, der Beschaffenheit des Stratum corneum und des Körpergewichts.39 Dies sollte auch mit Blick auf den Grad der systemischen Exposition bei kutaner Gabe bedacht werden.39-42 Bei lokal begrenzten MSK-Schmerzen (v.a. Arthrose) sollten nach Möglichkeit zuerst topische NSAR, sofern indiziert, und erst in zweiter Linie orale NSAR eingesetzt werden.21 Da Menschen mit MSK-Schmerzen vor allem aus Sorge vor Nebenwirkungen und Abhängigkeiten einer medikamentösen Schmerztherapie kritisch gegenüberstehen, ist die bessere Verträglichkeit einer topischen Applikation bei vergleichbarer Wirksamkeit ein wesentlicher Vorteil gegenüber der oralen Einnahme. Auf die Evidenz dieses Ansatzes geht der Beitrag im Folgenden ausführlicher ein.5. Evidenz topischer NSAR in der Therapie akuter MSK-Schmerzen
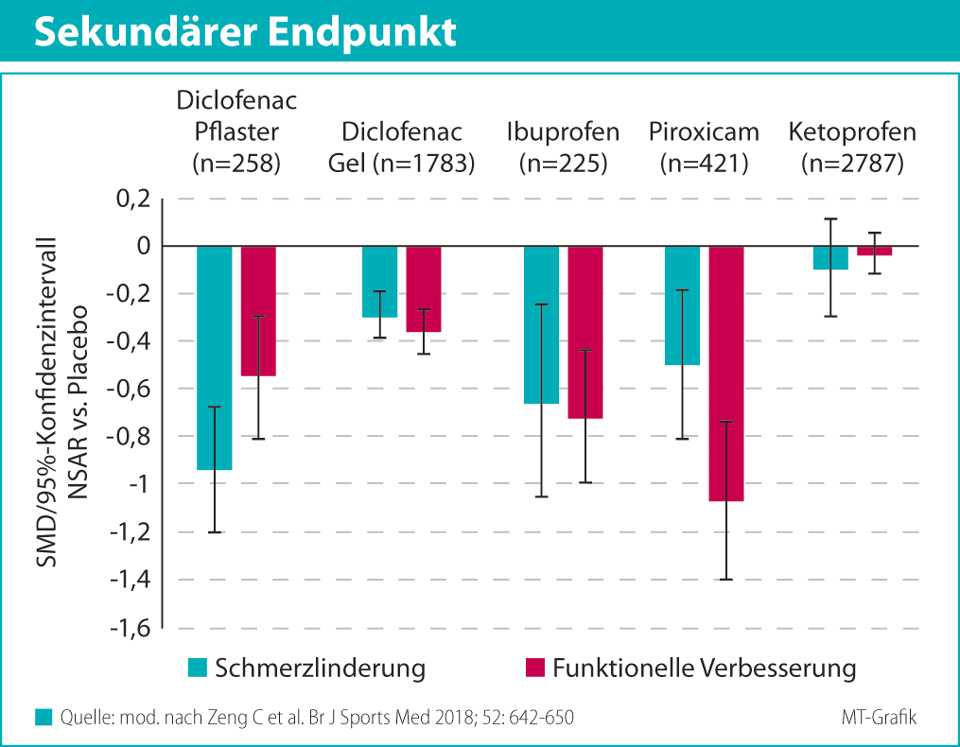
Diclofenac, Ibuprofen, Ketoprofen, Piroxicam und Indometacin gehören zu den wichtigen Vertretern der nicht-verschreibungspflichtigen, topischen NSAR. Zu diesen Arzneimitteln liegen Ergebnisse aus mehreren klinischen Studien zur analgetischen Wirksamkeit und Verträglichkeit bei MSK-Schmerzen vor.5,7,32,41,43 Diese umfassen sowohl akute als auch chronische Schmerzen. Speziell zur Therapie akuter MSK-Schmerzen hat ein Cochrane-Review die meist placebokontrollierten, randomisierten, doppelblinden Studien zu NSAR erfasst und ausgewertet.7 In diese Studien eingeschlossen waren mehrheitlich Patienten mit akuten Schmerzen aufgrund von Zerrung, Verstauchung oder Überbeanspruchung im Zusammenhang mit sportlicher Betätigung. Die topische Behandlung begann innerhalb weniger Stunden oder Tage und dauerte zwischen fünf Tage und drei Wochen an. Die Auswertung erfolgte nach ca. sieben Behandlungstagen. Das Mindestalter lag bei 16 Jahren (Durchschnittsalter in den Studien zwischen 25 und 57 Jahre). Primärer Endpunkt der Cochrane-Analyse war eine erfolgreiche Behandlung, definiert als eine mindestens 50%-ige Reduktion des MSK-Schmerzes, bzw. eine als sehr gut oder exzellent bewertete Behandlung oder fehlender bzw. schwacher Schmerz in Ruhe oder in Bewegung.7Quelle: mod. nach Derry S et al. Cochrane Database Syst Rev 2015; 6: CD007402
5.1 Wirksamkeit
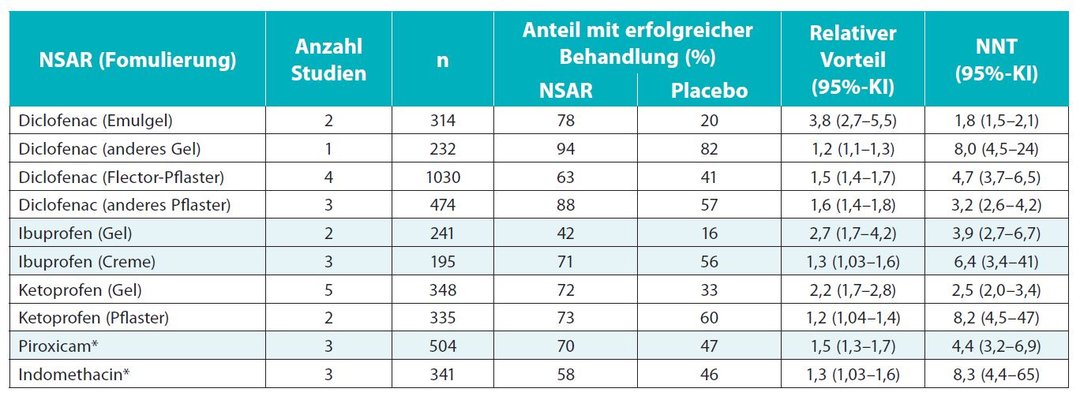
Die Ergebnisse zum primären Endpunkt sind in Tabelle 1 zusammengefasst. In die Analyse allein zu Diclofenac flossen 10 placebokontrollierte Studien mit über 2000 Patienten ein. Unter dem NSAR (Dosisbereich 60–280 mg täglich) erreichten 74 % der Teilnehmer den primären Endpunkt „erfolgreiche Behandlung“ gegenüber 47 % mit Placebo (relativer Vorteil [relative benefit, RB] 1,60). Die Number Needed to Treat (NNT) lag bei 3,7. Sie gibt allgemein die Anzahl der notwendigen Behandlungen an, um gegenüber einer Alternativmethode einen einzelnen positiven Ausgang zu erreichen. Je geringer die NNT, desto effektiver die Intervention – im Idealfall beträgt die NNT 1. Für den Vergleich zwischen Ibuprofen (Dosisbereich 300–800 mg täglich) und Placebo wurden fünf Studien mit insgesamt 436 Patienten berücksichtigt. Hier lag der Anteil der Patienten mit erfolgreicher Behandlung unter Ibuprofen (unabhängig von der Formulierung) bei 55 % versus 33 % in den gepoolten Placeboarmen (RB 1,6; NNT 4,6). Zu Ketoprofen (Dosisbereich 100–450 mg täglich) berücksichtigte das Review sieben placebokontrollierte Studien (n = 683). Den primären Endpunkt erreichten unter diesem NSAR 73 % gegenüber 47 % unter Placebo (RB 1,6). Die NNT betrug 3,9 (Tab. 1). Für den Vergleich zwischen Piroxicam (Dosisbereich 15–20 mg täglich) und Placebo wurden drei Studien mit n = 504 Teilnehmern einbezogen. In der Analyse lag der Anteil erfolgreich behandelter Patienten im Verumarm bei 68 % und im Placeboarm bei 47 % (RB 1,5; NNT 4,4). Die placebokontrollierte Wirksamkeitsprüfung von Indometacin (12–60 mg täglich) umfasste lediglich drei Studien (n = 341) mit insgesamt geringem Wirksamkeitsvorteil gegenüber Placebo (RB 1,3; NNT 8,3).7 Wie eine Subanalyse, stratifiziert nach der Formulierung (Pflaster, Gel oder Creme), andeutete, gab es hinsichtlich der Effektstärke – und entsprechend der NNT – Unterschiede (Tab. 1). Die Anwendung in Form von Gelen oder Cremes war in dieser Analyse in vielen Fällen mit einer größeren Effektstärke als in Form von Pflastern assoziiert.75.2 Verträglichkeit
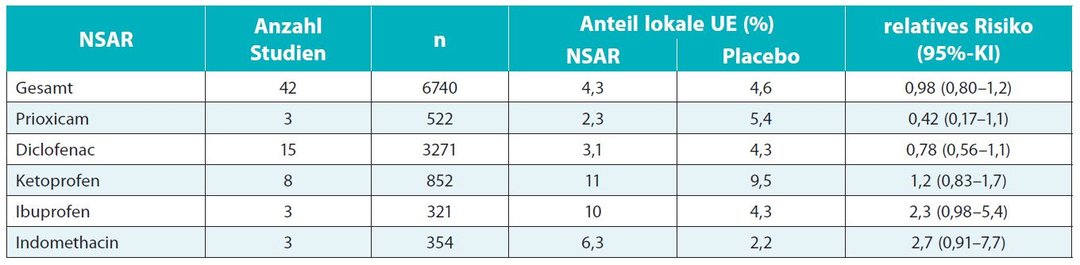
Die Analyse der Verträglichkeit unterschiedlicher NSAR zeigte für die Substanzklasse der topischen NSAR im Cochrane-Review keinen signifikanten Unterschied hinsichtlich lokaler UE (n = 3619) gegenüber Placebo (n = 3121; Tab. 2). Die Anteile der Studienteilnehmer mit lokalen UE betrug im Verumarm 4,3 % gegenüber 4,6 % unter Placebo (Risk Ratio [RR] 0,98). Diese UE wurden allgemein als mild und vorrübergehend beschrieben. Auch in der individuellen Verträglichkeitsanalyse der verschiedenen topischen NSAR ergab sich kein signifikanter Unterschied in der Inzidenz lokaler UE im Vergleich zu Placebo (Tab. 2).7 Der Cochrane-Review untersuchte zudem die Inzidenz systemischer UE bei Anwendung topischer NSAR (n = 2956). Auch bei dieser Verträglichkeitsanalyse ergab sich kein signifikanter Unterschied im Vergleich zu Placebo (n = 2620). Unter NSAR berichteten 3,1 % der Behandelten von systemischen UE gegenüber 3,5 % unter einer Scheinbehandlung (RR 0,96 [95%-KI: 0,73–1,3]). Ebenso wie bei den lokalen UE war auch in diesem Fall kein signifikanter Unterschied zu Placebo auf der Ebene der individuellen NSAR zu erkennen.76. Evidenz topischer NSAR in der Therapie chronischer MSK-Schmerzen
Auch für chronische MSK-Schmerzen liefert ein weiterer Cochrane-Review eine gute Übersicht über die Wirksamkeit und Verträglichkeit von topisch applizierten NSAR.32,43 Er berücksichtigte randomisierte, kontrollierte, doppelblinde klinische Studien zu Patienten (Mindestalter 16 Jahre) mit radiologisch bestätigter Arthrose und Schmerzempfinden von mindestens dreimonatiger Dauer und mindestens moderater Intensität. Das Durchschnittsalter in den berücksichtigten Studien lag zwischen 59 und 65 Jahren und die Behandlungsdauer zwischen 2 und 12 Wochen. Die meisten Patienten wurden in großen Studien über einen Zeitraum von 6–12 Wochen behandelt, aber es gab auch mehrere kleinere Studien mit Behandlungszeiträumen von 2–3 Wochen. Auch in diesem Cochrane-Review war der primäre Endpunkt die erfolgreiche Behandlung, definiert als eine mindestens 50%-ige Reduktion der Schmerzen, bzw. eine als sehr gut oder exzellent bewertete Behandlung oder fehlender bzw. schwacher Schmerz in Ruhe oder in Bewegung.326.1 Wirksamkeit
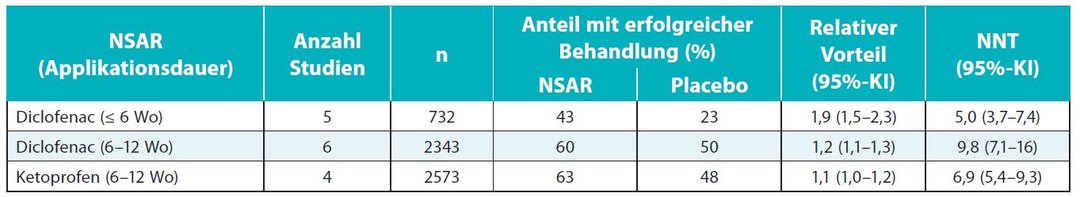
Für eine gepoolte Wirksamkeitsanalyse lag eine ausreichende Datenmenge nur zu den NSAR Diclofenac und Ketoprofen vor (Tab. 3). In den Studien zu Diclofenac (n = 2343) zeigte sich ein Wirksamkeitsvorteil gegenüber Placebo. Die Anteile der Patienten mit erfolgreicher Behandlung betrugen bei einer Behandlungszeit von 6–12 Wochen unter dem NSAR 60 % gegenüber 50 % unter Placebo (RB 1,2; NNT 9,8). Bei kürzerer Behandlungszeit von ≤ 6 Wochen (n = 732) erreichten 43 % der Studienteilnehmer mit dem NSAR den primären Endpunkt einer erfolgreichen Behandlung (vs. 23 % unter Placebo). Das ergab einen relativen Vorteil für Diclofenac von 1,9 und eine NNT von 5,0. Unter Ketoprofen (Dosisbereich 50–200 mg täglich) erreichten bei einer Therapiedauer zwischen 6 und 12 Wochen 63 % der Patienten den primären Endpunkt und 48 % unter Placebo (RB 1,1; NNT 6,9; n = 2573). Studien zu Ketoprofen mit einer Behandlungszeit von weniger als 6 Wochen waren nach Aussage der Autoren des Cochrane-Reviews nicht verfügbar.326.2 Verträglichkeit
In der Verträglichkeitsanalyse des oben bereits erwähnten Cochrane-Reviews zur Langzeitanwendung bis zwölf Wochen wurden zu Diclofenac 15 Studien mit insgesamt 3658 Teilnehmern berücksichtigt.32 Der Anteil derjenigen mit lokalen UE betrug unter dem NSAR 14 % (0–51 %) und im Placeboarm 7,8 % (0–43 %; RR 1,8 [95%-KI: 1,5–2,2]). Zu Ketoprofen lagen 4 Studien (n = 2621) vor und unter diesem NSAR berichteten 15 % (5,6–28 %) der Teilnehmer von lokalen UE gegenüber 13 % (5,9–20 %) unter Placebo (RR 1,0 [95%-KI: 0,85–1,3]), es fand sich also kein Unterschied. Für beide NSAR wurden die lokalen UE allgemein als mild und vorübergehend beschrieben.32 Die Metaanalyse untersuchte auch die Inzidenz systemischer UE unter topischer NSAR-Applikation. In keiner der 14 berücksichtigten Studien (n = 2237) ergab sich diesbezüglich ein signifikanter Unterschied zwischen Verum- und Placeboarm (RR 0,89 [95%-KI: 0,59–1,3] bzgl. Diclofenac [n = 1266]; RR 1,2 [95%-KI: 0,77–1,8] bzgl. anderer topischer NSAR [n = 971]). Die in den berücksichtigten Studien registrierten systemischen UE (u.a. Kopfschmerz, Diarrhö) wurden allgemein als mild beschrieben.32 Diese Ergebnisse stehen im Einklang mit den Ergebnissen zu lokalen und systemischen UE unter topischen NSAR, wie sie bei Zeng et al. beschrieben wurden.41 Auch in dieser Metaanalyse ergab sich kein signifikanter Unterschied zwischen NSAR und Placebo bezüglich lokaler Hautreaktion, gastrointestinaler und kardiovaskulärer UE. Jedoch zeigte diese Metaanalyse unter NSAR eine höhere Therapieabbruchrate als unter Placebo (Odds Ratio [OR] 1,56 [95%-KI: 1,21–2,00]), ohne eine Erklärung dafür zu bieten.416.3 Topische und orale NSAR im direkten Vergleich
Ein wichtiger Aspekt, der bereits angesprochen wurde, ist der direkte Vergleich zwischen topischen und oralen NSAR bezüglich Wirksamkeit und Verträglichkeit. Eine explorative Analyse von fünf direkten Vergleichsstudien (topische NSAR: n = 877; orale NSAR: n = 858), die ebenfalls im Kontext der Therapie chronischer MSK-Schmerzen im Cochrane-Review von Derry et al. (2016) durchgeführt wurde, deutet an, dass zwischen beiden Applikationsformen kein signifikanter Unterschied in der Wirksamkeit besteht.32 Der Anteil der Patienten mit erfolgreicher Behandlung betrug bei topischer Applikation 55 % gegenüber 54 % bei oraler Gabe (RR 1,03 [95%-KI: 0,95–1,1]). Lokale UE wurden bei topischer Applikation (n = 846) erwartungsgemäß häufiger berichtet als bei oraler Gabe (n = 805; Anteile 22 % vs. 5,8 %; RR 3,7 [95%-KI: 2,8–5,1]). Die Inzidenz systemischer UE hingegen war bei topischer Applikation signifikant geringer (17 % vs. 26 %; RR 0,66 [95%-KI: 0,56–0,77]).32 Diese Daten von immerhin fast 900 Patienten zeigen für die ärztliche Praxis den ganz eindeutigen Vorteil von topisch im Vergleich zu systemisch applizierten NSAR, da weniger systemische Nebenwirkungen auftraten. Nebenwirkungen sind ein Hauptargument von Patienten gegen die Einnahme von NSAR.7. Zusammenfassung
Die Daten aus großen Metaanalysen und Cochrane-Reviews zeigen, dass akute und chronische MSK-Schmerzen für die Betroffenen erhebliche negative Auswirkungen auf physische, psychische und soziale Aspekte ihres Lebens haben. Deshalb müssen Schmerzen in der ärztlichen Praxis ernstgenommen und behandelt werden. Die Therapie sollte dabei einen multimodalen Ansatz nicht-pharmakologischer und pharmakologischer Interventionen verfolgen, was sich bereits im biopsychosozialen Krankheitsmodell widerspiegelt. Dabei kommt dem Patienten-Selbstmanagement eine bedeutende Rolle zu – nicht zuletzt aufgrund der geringen Bereitschaft, wegen Schmerzen einen Arzt aufzusuchen. Bei allen Patienten mit akuten oder chronischen MSK-Schmerzen kann der Einsatz topischer nicht-verschreibungspflichtiger NSAR aus mehreren Gründen empfohlen werden: Topische NSAR sind einfach anzuwenden, sie lassen sich somit als Selbstmedikation gut in das Patienten-Selbstmanagement integrieren. Außerdem belegen die vorhandenen Studien klar, dass das Risiko für Nebenwirkungen im Vergleich zu oralen NSAR unter topischer Applikation geringer ist, ohne dass es zu relevanten Wirksamkeitseinbußen kommt. Dies kann aufgrund der nicht unberechtigten Sorge der Patienten vor möglichen systemischen Nebenwirkungen zu einer höheren Akzeptanz und Compliance und damit zu einer besseren Kontrolle von MSK-Schmerzen beitragen.Literatur
a Fragebogen zur Beurteilung der Auswirkungen von Osteoarthritiden des Hüft- und/oder Kniegelenks hinsichtlich Schmerz (5 Fragen), Steifigkeit (2 Fragen) und physische Funktion (17 Fragen) auf einer Skala von 0 bis 4.
1. GBD 2019 Diseases and Injuries Collaborators Lancet 2020; 396: 1204-1222
2. Hagen M et al. Scand J Pain 2020; 20: 575-589
3. Leadley RM et al. J Pain Palliat Care Pharmacother 2012; 26: 310-325
4. Wenig CM et al. Eur J Pain 2009; 13: 280-286
5. Derry S et al. Cochrane Database Syst Rev 2017; 5: CD008609
6. National Clinical Guideline Centre (UK). Osteoarthritis: Care and Management in Adults. London: National Institute for Health and Care Excellence (UK); 2014 Feb. PMID: 25340227
7. Derry S et al. Cochrane Database Syst Rev 2015; 6: CD007402
8. Thomas MJ, Neogi T. Osteoarthritis Cartilage 2020; 28: 870-873
9. Dunwoody CJ et al. J Perianesth Nurs 2008; 23: S15-S27
10. Blyth FM et al. Am J Public Health 2019; 109: 35-40
11. Deere KC et al. Pain 2012; 153: 1932-1938
12. de.statista.com/statistik/daten/studie/153908/umfrage/fettleibigkeit-unter-erwachsenen-in-oecd-laendern/ (letzter Zugriff: Februar 2021)
13. Data on file
14. Booth J et al. Musculoskeletal Care 2017;
15: 413-421 15. Hawker GA. Clin Exp Rheumatol 2017; 35 (Suppl 107): 8-12
16. Kroenke K et al. J Pain 2011; 12: 964-973
17. Ethgen O et al. Qual Life Res 2004; 13: 321-330
18. Hagen M, Georgescu AM. WCPH 2020; Poster #DT.31, International survey: Real-world pain management strategies
19. Babatunde OO et al. PLoS One 2017; 12: e0178621
20. May S. Nat Rev Rheumatol 2010; 6: 199-209
21. Hagen M, Alchin J. Pain Manag 2020; 10: 117-129
22. DGOOC S2k-Leitlinie Koxarthrose (Stand: Juli 2019)
23. DGOOC S2k-Leitlinie Gonarthrose (Stand: Januar 2018)
24. DEGAM S1-Handlungsempfehlung Nackenschmerzen (Stand: Juni 2016)
25. Nationale VersorgungsLeitlinie Nicht-spezifischer Kreuzschmerz, Langfassung, 2. Auflage, 2017
26. Deutsche Schmerzgesellschaft e.V., Leitlinie Langzeitanwendung von Opioiden bei chronischen nicht-tumorbedingten Schmerzen (LONTS), 2. Aktualisierung, 2020
27. Megale RZ et al. J Pain 2018; 19: 475.e1-475.e24
28. Rao P, Knaus EE. J Pharm Pharm Sci 2008; 11: 81s-110s
29. Pelletier JP et al. Semin Arthritis Rheum 2016; 45: S22-S27
30. Sooriakumaran P. Postgrad Med J 2006; 82: 242-245
31. Biederman RE. J Orthop Sports Phys Ther 2005; 35: 356-367
32. Derry S et al. Cochrane Database Syst Rev 2016; 4: CD007400
33. Irvine J et al. Drug Dev Ind Pharm 2018; 44: 173-183
34. Folzer E et al. Die Pharmazie 2014; 69: 27-31
35. Miyatake S et al. Br J Clin Pharmacol 2009; 67: 125-129
36. Efe T et al. Knee Surg Sports Traumatol Arthrosc 2014; 22: 345-350
37. Celebi D et al. Int J Pharm 2016; 514: 238-243
38. Patel A et al. Int J Pharm 2013; 457: 9-13
39. Seefried L et al. Ther Adv Musculoskelet Dis 2020; 12: 1-13
40. Zhang Q et al. J Pain Res 2020; 13: 1621-1627
41. Zeng C et al. Br J Sports Med 2018; 52: 642-650
42. Gondolph-Zink B, Gronwald U. Aktuelle Rheumatol 1996; 21: 298-304
43. Wiffen PJ, Xia J. Curr Med Res Opin 2020; 36: 637-650
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).