Aggressive Hirntumoren entziehen sich Behandlungen durch komplexe Netzwerkmechanismen
 Diffuse Hirntumornetzwerke fördern Überleben und Therapieresistenz, sind aber im Labor gezielt angreifbar.
© fotomek – stock.adobe.com
Diffuse Hirntumornetzwerke fördern Überleben und Therapieresistenz, sind aber im Labor gezielt angreifbar.
© fotomek – stock.adobe.com
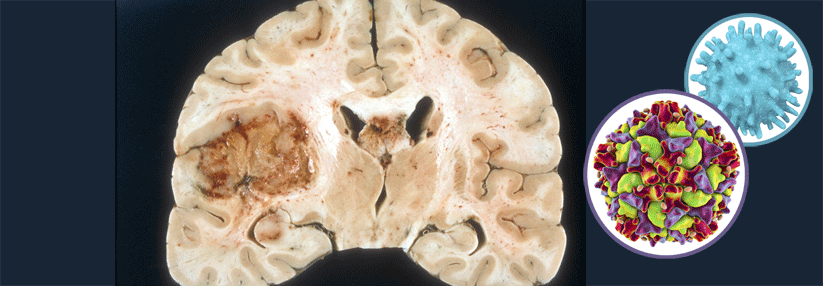
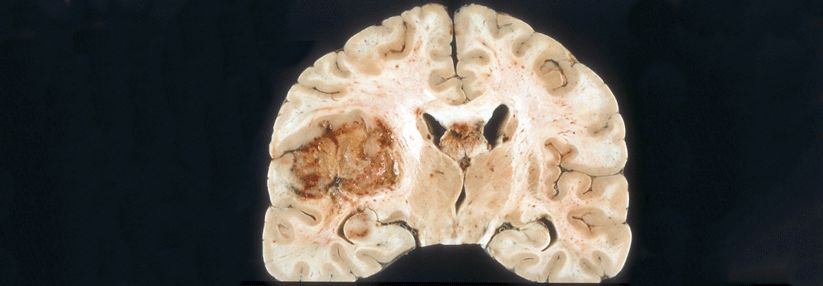
Da sie das Gehirn diffus kolonisieren, stellen unheilbare Hirntumoren Erkrankungen des gesamten Organs dar, erklärte Prof. Dr. Frank Winkler vom Universitätsklinikum Heidelberg. Dabei bedienen sie sich neuronaler Mechanismen und bilden neuritenähnliche Fortsätze und Netzwerke aus. „Man sieht, dass das gesamte Gehirn von diesen Tumorauswüchsen infiltriert ist“, schilderte der Experte. Eine Resektion alleine löse das Problem nicht.
Forschende konnten nachweisen, dass vor allem jene Zellen eine Radiotherapie oder eine Behandlung mit Temozolomid (TMZ) überleben, die intensiv mit anderen verbunden sind. Diese bilden laut dem Kollegen die minimale Resterkrankung: „Dieses Netzwerk breitet sich beim Rezidiv wieder aus und repopuliert das Gewebe.“ Zudem vernetzten sich die verbliebenen Zellen nach der Therapie stärker. Damit stelle es einen Mechanismus der primären und adaptiven Resistenz dar, einen Teil des Verbundes zu bilden. Stört man die Ausbildung dieser funktionalen Netzwerke, indem man ein essenzielles Protein ausschaltet, so scheint dies im Mausmodell eine Strahlenresistenz zu überwinden.
Immuninfiltrat in Hirnmetastasen sagt Überleben voraus
Bei Adenokarzinomen der Lunge gehen Hirnmetastasen mit schlechten Überlebenschancen einher, schilderte Dr. Dr. LENA JASSOWICZ, Universitätsklinikum Heidelberg. Ihr Team konnte Alter, Geschlecht, Karnofsky-Index und das Vorliegen extrakranialer Filiae als unabhängige Prädiktoren für das OS bestätigen. Zudem war bereits bekannt, dass der PD-L1-Status sowie die Zahl der intratumoralen T-Zellen eine prognostische Bedeutung aufweisen. Laut den neuen Daten scheint dies auch für die Infiltration von B-Lymphozyten und weiteren Immunzelltypen zu gelten.
In resezierten Hirnmetastasen von 76 Erkrankten identifizierten die Forschenden vier distinkte Immunprofile. Diese korrelierten hochsignifikant mit den Überlebensaussichten Betroffener (p < 0,001). Am günstigsten fiel die Prognose aus, wenn sowohl zahlreiche T-Lymphozyten als auch viele B-Zellen das Tumorgewebe infiltrieren. Das andere Extrem stellten Herde dar, in denen sich vor allem Makrophagen und Mikroglia fanden („Immune Desert“). Die beiden übrigen Profile weisen eine intermediäre Einwanderung von T-Zellen auf und unterscheiden sich danach, inwiefern inflammatorische antigenpräsentierende Zellen präsent sind. Zukünftig will das Team der Referentin untersuchen, was diese Unterschiede verursachen könnte und ob sich Serumzytokine als Surrogatmarker für das Immunprofil der ZNS-Filiae eignen.
Quelle:
Jassowicz L. 4. Deutscher Krebsforschungskongress; Vortrag „Identification of prognostically distinct immune landscapes in lung adenocarcinoma brain metastases“
Gap-Junction-Inhibitor wird bereits getestet
Meclofenamat, das u. a. Gap Junctions inhibiert und für andere Indikationen bereits zugelassen ist, scheint wiederum die Effizienz von TMZ zu steigern. Momentan testen Forschende den Wirkstoff in einer Phase-1/2-Studie bei Patient:innen mit rezidivierendem MGMT-methylierten Glioblastom als potenziellen Kombinationspartner für diese Chemotherapie. Präklinische Untersuchungen implizieren zudem, dass Aktivatoren der Proteinkinase C die Konnektivität reduzieren und die Glioblastomprogression ausbremsen, besonders in Kombination mit einer Radiotherapie.
Innerhalb des Glioblastomnetzwerkes entdeckten Fachleute Schrittmacherzellen, von denen ausgehend sich rhythmische Calciumpulse durch die Tumorzellen ausbreiten. Diese stimulieren proonkogene Signalwege und fördern Proliferation und Progression. Wenn Wissenschaftler:innen im Labor einen verantwortlichen Ionenkanal (KCa3.1) inhibierten oder dessen Expression herunterregulierten, wuchsen experimentelle Tumoren langsamer und Versuchstiere lebten länger.
Wie Prof. Winkler betonte, wurde Senicapoc, ein Inhibitor dieses Ionenkanals, bereits für mehrere Indikationen, darunter COVID-19, Sichelzellanämie und Asthma, am Menschen getestet und für sicher befunden. In präklinischen Gliommodellen zeigte der Wirkstoff potenzielle Synergien mit einer Radiotherapie. Als Teil der Phase-1/2a-Studie DYSRUPT sollen 100 Erkrankte mit neu diagnostiziertem Glioblastom und unmethyliertem MGMT-Promotor nach der Resektion Senicapoc erhalten. In Phase 2 werden der Inhibitor und TMZ als Kombinationspartner für die Strahlentherapie verglichen. „Der Standard ist beinahe wirkungslos“, kommentierte der Referent. Nur 18,5 % bleiben mit TMZ plus Bestrahlung sechs Monate rezidivfrei.
Unabhängig von den Schrittmachern können Gliomzellen auch über Synapsen zu gesunden Neuronen wachstumsstimulierende und invasionsfördernde Signale erhalten. Dabei spielen calciumpermeable AMPA-Rezeptoren eine wichtige Rolle, die normalerweise im adulten Gehirn kaum vorkommen. Perampanel, ein Hemmstoff dieses Rezeptorsubtyps, kann in Zellkultur die Proliferationsrate und Zelldichte deutlich reduzieren. Auch dieser Ansatz befindet sich bereits in der klinischen Erprobung. An PerSurge sollen 66 progrediente Glioblastompatient:innen an 13 deutschen Zentren teilnehmen, bei denen eine Indikation für eine Re-Resektion besteht. Sie erhalten vor und nach dem Eingriff 1:1 randomisiert entweder Perampanel oder Placebo.
Experte setzt darauf, die Netzwerke zu stören
Alles in allem stellt die Unterbrechung der Tumornetzwerke laut dem Onkologen ein wirksames Mittel dar, um die Effektivität von Bestrahlung, Chemotherapie und anderen Behandlungen zu steigern. Er hofft zukünftig auf neurowissenschaftlich informierte Krebstherapien: „Es scheint, dass wir einen Fuß in die Tür bekommen, wenn wir auf diese Signalwege der frühen neuronalen Entwicklung abzielen, die im erwachsenen Gehirn nicht mehr so wichtig sind.“ Die Herausforderung besteht darin, gesunde ZNS-Strukturen nicht zu schädigen.
Zuletzt merkte Prof. Winkler an, dass sich neuritenähnliche Auswüchse und Neuron-Tumor-Synapsen ebenfalls in kranialen Metastasen nicht-neuronaler Tumoren finden. Dies betrifft beispielsweise Mammakarzinome und Melanome. Auf die Frage hin, ob diese Malignome auch mit peripheren Nerven interagieren, antwortete er: „Meine Vorhersage wäre, dass die Chance 95 % beträgt, so etwas zu finden.“
Quelle:
Winkler F. 4. Deutscher Krebsforschungskongress; Vortrag „Neuro-cancer crosstalk drives brain invasion and metastasis“
Falls Sie diesen Medizin Cartoon gerne für Ihr nicht-kommerzielles Projekt oder Ihre Arzt-Homepage nutzen möchten, ist dies möglich: Bitte nennen Sie hierzu jeweils als Copyright den Namen des jeweiligen Cartoonisten, sowie die „MedTriX GmbH“ als Quelle und verlinken Sie zu unserer Seite https://www.medical-tribune.de oder direkt zum Cartoon auf dieser Seite. Bei weiteren Fragen, melden Sie sich gerne bei uns (Kontakt).