Was macht eine Gesundheitsapp erstattungsfähig?
 Apps für die Gesundheit gibt es viele. Doch welche helfen wirklich?
© iStock/DragonImages
Apps für die Gesundheit gibt es viele. Doch welche helfen wirklich?
© iStock/DragonImages
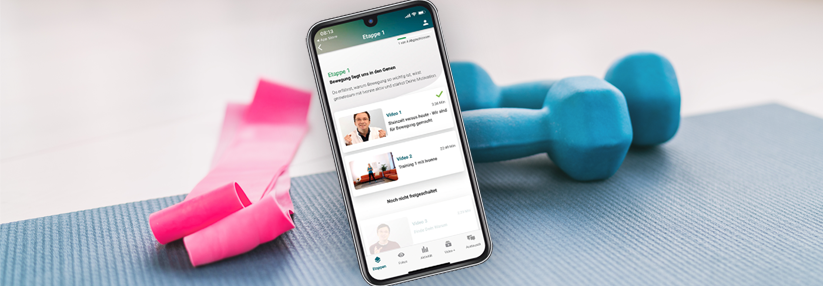
Grundlage für die Verordnung digitaler Gesundheitsanwendungen (DiGA) soll letztlich ein „DiGA-Verzeichnis“ nach § 139e SGB V sein, in dem die erstattungsfähigen Medizinprodukte der Risikoklassen I und IIa gelistet werden. Die Funktion der Produkte muss hauptsächlich auf digitalen Technologien beruhen und das Erkennen, Überwachen, Behandeln oder Lindern von Krankheiten oder das Erkennen, Behandeln, Lindern oder Kompensieren von Verletzungen oder Behinderungen unterstützen.
Wie Christian Klose, Unterabteilungsleiter im Bundesministerium für Gesundheit (BMG), darlegt, sollen Patienten schneller von digitalen Anwendungen profitieren. Klose zitiert seinen Dienstherren Jens Spahn: „Digitalisierung zu ignorieren, ist ein Kunstfehler. Nichtstun ist keine Option.“
Hersteller muss positive Effekte für Patienten nachweisen
Die Kosten für eine DiGa-Verordnung soll die gesetzliche Krankenversicherung vorerst für ein Jahr tragen. Der Hersteller bzw. Anbieter muss dann beim BfArM nachweisen, dass z.B. seine medizinische App die Versorgung des Patienten verbessert. Zeigen sich positive Effekte, ist die Verlängerung der Kostenübernahme möglich. Den Krankenkassen wird zugleich ermöglicht, die digitalen Innovationen zu fördern oder zusammen mit Dritten zu entwickeln oder von diesen entwickeln zu lassen.
Das parlamentarische Verfahren zum Digitale-Versorgung-Gesetz (DVG) läuft im Herbst. Der Start des Bewertungsverfahrens ist für das erste Quartal 2020 vorgesehen, wie Dr. Wolfgang Lauer, Leiter der Abteilung „Medizinprodukte“ beim BfArM berichtet. Die Evidenz- bzw. Nachweisanforderungen würden zurzeit entwickelt. Dabei arbeiten Mitarbeiter von BfArM, BMG und dem „Health Innovation Hub“, der Ideenfabrik des BMG für digitale Gesundheitslösungen, eng zusammen. Im Fokus stehen dabei Datensicherheit, Datenschutz, Transparenz und Anwenderfreundlichkeit.
Bundesrat sieht Änderungsbedarf
Klassische Methodenbewertung für Apps & Co. nicht geeignet
Beim Gemeinsamen Bundesausschuss (G-BA) laufen seit Langem Verfahren zur Nutzenbewertung von neuen Arzneimitteln und Methoden, die für Beschlüsse für oder gegen die Aufnahme in den Leistungskatalog der gesetzlichen Krankenversicherung entscheidend sind. Der unparteiische Vorsitzende Professor Josef Hecken ist überzeugt, dass sich damit jedoch nicht die Bewertung von Apps & Co. realisieren lässt, denn bei diesen fehle in vielen Fällen die Evidenz zum Nutzen. Es müsse deshalb „der Versuch unternommen werden, für digitale Medizinprodukte ein Bewertungsverfahren zu etablieren, das der besonderen Spezifika dieser Produkte entspricht.“ Zugleich müssen der diagnostische bzw. therapeutische Nutzen, die medizinische Notwendigkeit und die Wirtschaftlichkeit gewährleistet sein. „Einen evidenzfreien Raum darf es nicht geben“, mahnt Prof. Hecken. Seiner Ansicht nach könnten digitale Produkte analog zur Bewertung von Arzneimitteln gegen seltene Erkrankungen betrachtet werden. Der G-BA darf die Erstattung von Orphan Drugs an die Mitwirkung in flächendeckenden Registerstudien knüpfen. Dies kann sich der Unparteiische auch als „Blaupause“ für digitale Produkte vorstellen: Eine Erstattung könnte nur derjenige Versicherte bekommen, der sich zu einer anwenderbezogenen Datenspende an das Register bereit erklärt.Verordnung mancher Produkte an Schwerpunktpraxen knüpfen
Der Bundesausschuss müsse die Anforderungen für diese Studienregister aber noch definieren, sagte Prof. Hecken auf eine diesbezügliche Nachfrage von Barbara Bitzer, Geschäftsführerin der DDG. Geklärt werden muss dabei u.a.: Wer führt die Register und wo werden sie geführt? Eingesetzt werden sollen auch sog. Study Nurses, die dafür sorgen, dass die Befüllung nach einheitlichen Kriterien erfolgt. Das alles soll in einer Richtlinie geregelt werden. Laut Prof. Hecken könnte es bei DiGA – ebenfalls analog zu Orphan Drugs – auch Einschränkungen zu Verordnern geben. Denkbar wäre z.B., dass nur diabetologische Schwerpunktpraxen Apps zur Insulinversorgung verschreiben dürfen. Eventuell müssten manche Produkte auch mit Alarmfunktionen ausgestattet sein, z.B. wenn sie aufgrund von Glukose-Messergebnissen den Insulinspiegel steuern (künstliche Bauchspeicheldrüse). Prof. Hecken hält für die Nutzung bestimmter Produkte wie eines Closed-Loop-Systems auch technikaffine Nutzer für erforderlich. Der Patient müsse deshalb einbezogen werden.Veranstaltung: „Das digitale Gesundheitswesen“