Diabetestechnologie Erste Studienergebnisse zum klinischen Nutzen eines AHCL-Systems
 Ein Advanced-Hybrid-Closed-Loop-System kann Menschen mit Typ-1-Diabetes dabei unterstützen, zuvor unüberwindbare therapeutische Hürden zu bewältigen.
© blocberry – stock.adobe.com
Ein Advanced-Hybrid-Closed-Loop-System kann Menschen mit Typ-1-Diabetes dabei unterstützen, zuvor unüberwindbare therapeutische Hürden zu bewältigen.
© blocberry – stock.adobe.com
Wir alle betreuen Menschen mit Typ-1-Diabetes, die nicht die individuell angestrebten Zielwerte im Sinne des HbA1c und der Zeit im Zielbereich mit einer ICT erreichen. Immer wieder erleben wir, dass dann eine zusätzliche kontinuierliche Glukosemessmethode als hilfreich angesehen wird. Vergleicht man die Studienlage bei diesen Menschen im Hinblick auf eine ICT bzw. Insulinpumpentherapie mit rtCGM, dann zeigt sich z.B. in der Diamond-Studie eine HbA1c-Verbesserung zugunsten der Insulinpumpentherapie von 0,3 %.1
Einige der Patienten, die ich betreute, waren dann zufrieden, wenn Sie neben der durchgeführten ICT nur CGM-Sensoren am Körper trugen, auch wenn die Glukoseeinstellung über viele Jahre hinweg nicht ihren und meinen Vorstellungen entsprach. „Eine zusätzliche Schlauchpumpe möchte ich nicht am Körper tragen, allenfalls eine Patchpumpe“, sagten mir einige Personen. Klar war aber auch, dass die zusätzliche Insulinpumpe bei diesen Menschen mit Diabetes nicht den Durchbruch in der Verbesserung der Therapie bringen würde.
Die individualisierten Probleme lagen darin, dass es trotz vorangegangener Diabetesschulungen immer wieder zu Fehleinschätzungen der KE/BE kam, Insulin wurde zu spät oder gar nicht appliziert. Aufgrund der hohen Glukosewerte kam es durch inadäquate Insulindosierungen zu vermehrten leichten, manchmal auch schweren oder sehr schweren Hypoglykämien. Beginnend mit der Minimed 670 G und dem Guardian-3-Sensor als Hybrid-Closed-Loop-System stehen jetzt seit ein paar Jahren AID-Systeme in Deutschland zur Verfügung, die bei diesen Problemstellungen sehr gut unterstützen können. Das Ziel der ADAPT-Studie war es deshalb zu evaluieren, ob und in welchem Ausmaß die Nutzung eines AID-Systems mit Advanced-Hybrid-Algorithmus bei der eingangs angesprochenen Patientengruppe von Nutzen ist.
Die ADAPT-Studie („Advanced Hybrid Closed Loop Study in Adult Population with Type 1 Diabetes“) wurde als randomisierte kontrollierte Studie mit 82 Patienten an 14 Zentren in drei europäischen Ländern (Frankreich, Deutschland und Vereinigtes Königreich) durchgeführt. Hierzulande waren vier Zentren beteiligt (Dres. Kolassa, Keuthage, Vortherms, Kröger).
In der Hoffnung, ihre Glukosestoffwechsellage deutlich zu verbessern, waren rasch einige Menschen mit langjährigem Typ-1-Diabetes gefunden, die an einer derartigen Studie teilnehmen wollten – trotz einer Insulinpumpe am Körper, was sich bisher viele in dieser Studiengruppe nicht vorstellen konnten. Zwar konnten die Teilnehmer in der Kontrollgruppe dieses System nicht tragen, sie beflügelte aber die Vorstellung, dass sie in der Fortsetzungsphase das AHCL-System bekamen und somit ebenfalls Erfahrungen damit sammeln konnten. In diesem Beitrag berichte ich über die ADAPT-Studie des ersten halben Jahres, die in Lancet Diabetes Endocrinology publiziert wurde.2 Die Ergebnisse der Fortsetzungsphase werden erwartungsgemäß auf dem ATTD-Kongress 2023 in Berlin präsentiert.
Studiendesign
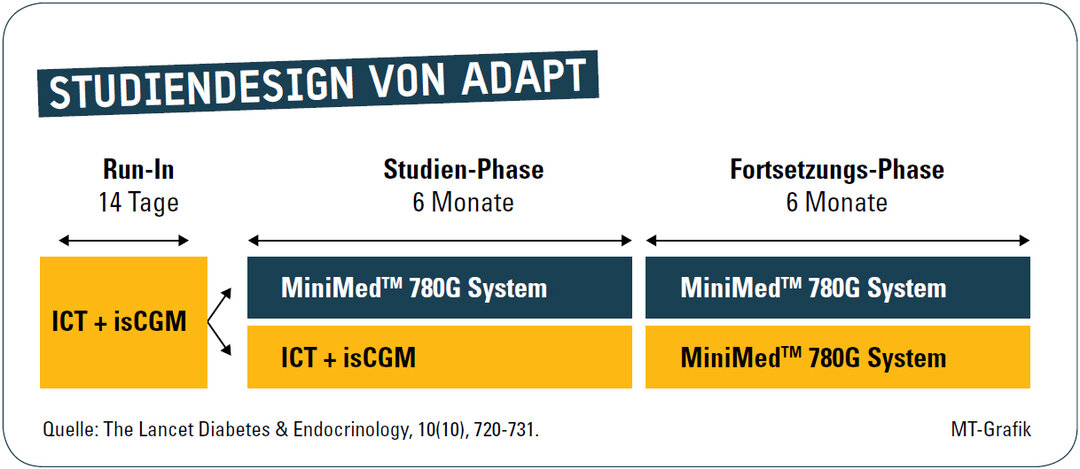
Nach einer 2-wöchigen Run-in-Phase wurden die Patienten für einen 6-monatigen Studienzeitraum in eine der beiden Studiengruppen randomisiert (Abb. 1):
- 41 Teilnehmer der Interventionsgruppe erhielten das MiniMed-780G-System mit dem Guardian-3-Sensor (musste noch kalibriert werden) in der 6-monatigen Studienphase.l Die 41 Teilnehmer der Kontrollgruppe verwendeten weiterhin ihre Standardtherapie ICT und nutzten für die Glukosekontrolle ein intermittierend scannendes CGM-System. Sowohl in der Run-in-Phase als auch in der Studienphase wurde für jeweils 14 Tage ein verblindetes CGM verwendet.
- 36 Teilnehmer in der Interventionsgruppe mit AID und AHCL-Algorithmus sowie 39 Teilnehmer in der Kontrollgruppe mit ICT und isCGM schlossen die Studie ab. Alle Probanden waren älter als 18 Jahre, hatten seit mindestens zwei Jahren einen Typ-1-Diabetes, zeigten mit einem HbA1c ≥ 8,0 % einen Therapieverlauf, der ihren Zielen nicht entsprach, und benutzen seit mindestens drei Monaten ein isCGM-System (Freestyle Libre 2).
Als primärer Endpunkt wurde der Unterschied im HbA1c zwischen beiden Gruppen nach sechs Monaten bestimmt. Weitere Endpunkte ergaben sich aus den abgeleiteten Messwerten des CGM-Systems: Die Zeit im Zielbereich (Time in Range, TiR) und die Zeit unterhalb bzw. oberhalb des Zielbereichs (Time below Range, TbR und Time above Range, TaR). Hinzu kamen Patient related outcomes (PROs) zur Ermittlung der Angst vor Hypoglykämien oder zur Zufriedenheit mit der Behandlung. Im Hinblick auf die Sicherheit der Therapie wurden außerdem die Anzahl von schweren Hypoglykämien (SH), diabetischen Ketoazidosen (DKA) und weiteren schweren unerwünschten Ereignissen (SUE) evaluiert.
Eines der fortschrittlichsten Systeme, das derzeit für die Behandlung von Menschen mit Typ-1-Diabetes im Alter von 7 bis 80 Jahren zugelassen ist, ist das MiniMed-780G-System von Medtronic. Mit seinem SmartGuard-Algorithmus, auch als Advanced-Hybrid-Closed-Loop-Algorithmus bezeichnet, lässt sich die Insulinabgabe automatisieren und sogar personalisieren, um erhöhte Glukosewerte auf der Grundlage der rtCGM-Messungen automatisch zu korrigieren. Unter Berücksichtigung des individuellen Insulinbedarfs passt der Algorithmus automatisch alle fünf Minuten die Insulinbasalrate auf der Grundlage der Glukosewerte an.
Das System ist für die Verwendung mit einem Glukosezielwert von 100 mg/dl (5,5 mmol/l) ausgelegt, der individuell angepasst und personalisiert werden kann, z.B. auf 110 oder 120 mg/dl bzw. 6,1 oder 6,7 mmol/l. Sicherheit und Nutzen eines AID-Systems der zweiten Generation (780G) wurden bereits in anderen Studien gezeigt: Dieses System ermöglicht gegenüber Vorgängermodellen nachweislich eine signifikant bessere glykämische Kontrolle. Noch nicht untersucht wurde bislang jedoch, ob und in welchem Ausmaß sich mit einem vom AHCL-Algorithmus gesteuerten AID-System eine ungenügende Glukosekontrolle verbessern lässt.
Ergebnisse
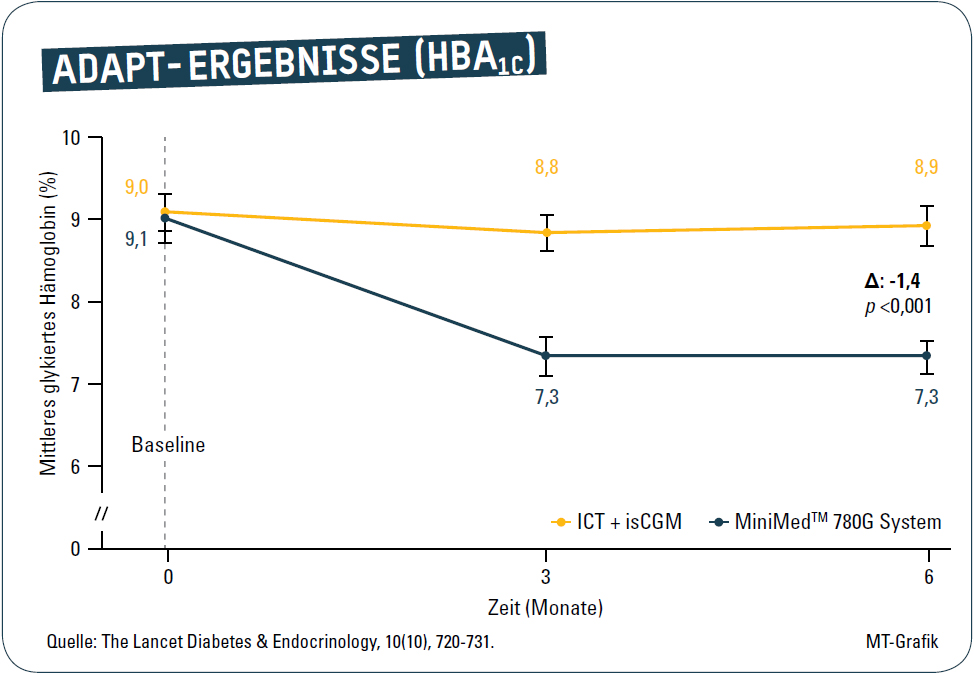
Nach 6 Monaten betrug die mittlere HbA1c-Absenkung in der Interventionsgruppe 1,7 % von 9,1 +/- 0,7 % auf 7,3 %. In der Kontrollgruppe war die Absenkung dagegen marginal (um 0,1 % von 9,0 +/- 1,0 % auf 8,9 %. Dies entspricht einem modellbasierten Behandlungseffekt von -1,4 % (p < 0,001) zugunsten der Interventions-Gruppe (Abb. 2).
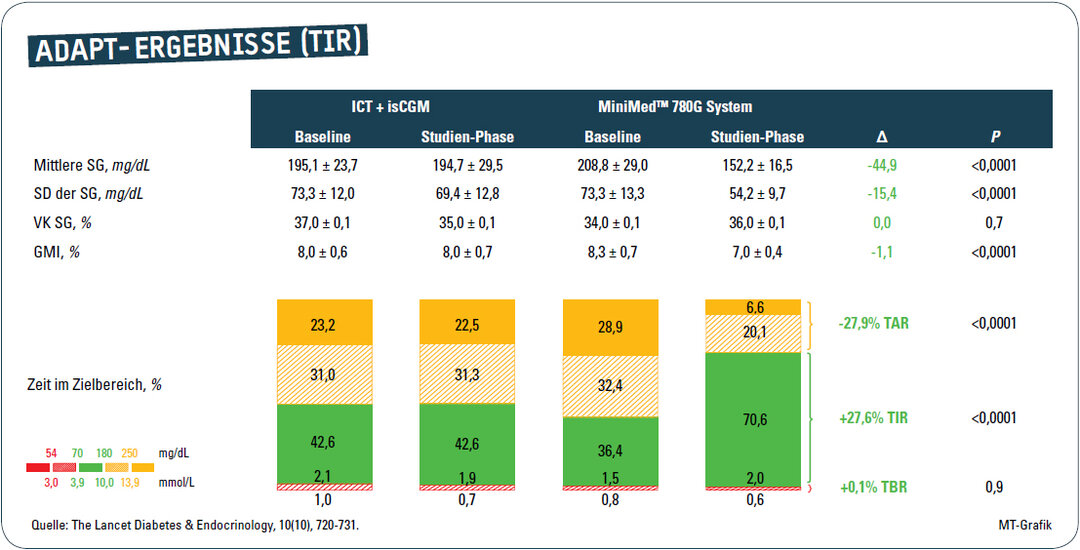
Während kein Teilnehmer aus der Kontrollgruppe nach sechs Monaten das glykämische Behandlungsziel von HbA1c < 7,0 % erreichte, schafften dies zehn der 36 Studienteilnehmer aus der Interventionsgruppe (28 %, p < 0,0011). Die Probanden aus beiden Gruppen hatten bei Studienbeginn mit 36 % in der Interventions- und 43 % in der Kontrollgruppe eine nicht den Therapiezielen entsprechende TiR. Teilnehmer der Interventionsgruppe wiesen nach sechs Monaten eine höhere TiR auf als die Menschen in der Kontrollgruppe (70,6 % vs. 43,6 %), was einem modellbasierten Behandlungseffekt von + 27,6 % entspricht (p < 0,001). 53 % der Patienten in der Interventionsgruppe erreichten eine von der Konsensusgruppe empfohlene TiR > 70 % (Kontrollgruppe 6,5 %).3 Die TbR < 70 mg/dl (3,9 mmol/l) soll unter 4 % liegen, dies wurde in beiden Behandlungsgruppen erfüllt, wobei die Teilnehmer in beiden Gruppen tagsüber eine TbR von 2,1 % für Werte < 70 mg/dl (3,9 mmol/l) hatten (nachts: Interventionsgruppe 1,7 %, Kontrollgruppe 2,4 %). In beiden Gruppen bestand somit eine angestrebte Zielwerterreichung gemäß Konsensus.3 Die zeigt sich auch bei den angestrebten < 1 % bei < 54 mg/dl (3 mmol/l) tagsüber und nachts in beiden Therapiegruppen. Höhere Glukosewerte oberhalb von 180 mg/dl (10 mmol/l) bzw. 250 mg/dl (13,9 mmol/l) wurden in der AHCL-Gruppe in 26,7 % und 6,6 % der Zeit gegenüber 53,8 % und 22,5 % in der Kontrollgruppe beobachtet (Abb. 3).
Im gesamten Zeitraum nutzten die Teilnehmer der Interventionsgruppe das CGM-System zu 92,2 % und den AID-Algorithmus zu 95,8 %. Sie verließen diesen nur 0,9-mal pro Woche, wodurch die Wahrscheinlichkeit für ein gutes Glukoseergebnis steigt. Der empfohlene Glukosezielwert von 100 mg/dl und die Einstellung für „Zeit aktives Insulin“ (active insulin time, AIT) wurde mit zwei Stunden empfohlen. Dies erforderte ein Umdenken sowohl für die Studienteilnehmer als auch für die Behandlungsteams. Hatten wir doch in den vergangenen Jahren immer wieder betont, dass die klinisch zu adressierende Insulinwirkzeit bei kurz wirksamen Insulinanaloga zwischen dreieinhalb bis vier Stunden liegt (bei manchen Menschen auch mal länger oder kürzer). Die AIT entspricht der Aggressivität des Algorithmus und nicht der tatsächlichen Insulinwirkzeit. So wurden sowohl der angestrebte Glukosezielwert bzw. die AIT „nur“ in 68,3 % bzw. 54,4 % der Zeit verwendet. Hier ist Aufklärung wichtig und vor allem auch ein Vertrauen in den lernenden Algorithmus.
Neben den klinischen Parametern wurden auch Patient related outcomes betrachtet (PROs). Bei Studienende war die Behandlungszufriedenheit bei den Teilnehmern in der Interventionsgruppe deutlich höher als bei denen in der Kontrollgruppe (p = 0,0003 für die Differenz im Diabetes Treatment Satisfaction Questionnaire, DTSQ). Bezüglich Diabetes Quality of life (DQoL) zeigte sich erstaunlicherweise kein Unterschied. Dies könnte u.a. mit der relativ häufig erforderlichen Kalibration des CGM-Systems (Guardian 3) zusammenhängen. Hinzu kommt eine deutliche Verbesserung der Zufriedenheit der Nutzer mit der Behandlung und eine Reduzierung der Angst vor Hypoglykämien. Der Hypoglycemia Fear Survey (HFS) nahm in beiden Gruppen gegenüber den Ausgangswerten ab, jedoch stärker in der Interventionsgruppe (p = 0,0409).
Während der 6-monatigen Studienphase traten keine schweren Hypoglykämien und Ketoazidosen auf. Es kam zu zwei SUEs, die aber nicht mit den Studiengeräten in Zusammenhang standen (eines je Behandlungsgruppe). Die tägliche Insulindosis unterschied sich nicht zwischen den beiden Gruppen.
Schlussfolgerung
Die ADAPT-Studie hat eindrucksvoll den klinischen Nutzen eines AHCL-Systems bei Erwachsenen mit Typ-1-Diabetes über sechs Monate gezeigt, wenn die ICT zusammen mit einem iscCGM-System nicht zu einem zufriedenstellenden Glukoseverlauf führt. Viele der Studienteilnehmer hatten bereits über einen längeren Zeitraum eine unbefriedigende Glukosestoffwechsellage. Die Diamond-Studie1 hatte bereits gezeigt, dass Menschen mit Typ-1-Diabetes und einem rtCGM-System gegenüber einer ICT von einer Insulinpumpentherapie profitieren (HbA1c-Verbesserung: 0,3 %).
Bedingt durch das AHCL-System kam es zu einer Senkung des HbA1c um 1,54 % im Vergleich zum Ausgangswert sowie 1,42 % im Vergleich zur Kontrollgruppe. Während in der Kontrollgruppe keine Person einen HbA1c unter 7 % erreichte, waren es in der Therapiegruppe 27,8 %. Zusätzlich zeigte sich eine eindrucksvolle Verbesserung der TiR sowie die Vermeidung von akuten Komplikationen wie Hypoglykämien, Ketoazidosen und anderen schweren unerwünschten Ereignissen.
Die aus ADAPT gewonnenen Erkenntnisse in Kombination mit den Erkenntnissen aus zuvor veröffentlichten Studien über andere automatische Insulinverabreichungssysteme legen nahe, dass AHCL eine wertvolle frühzeitige Behandlungsoption darstellt für erwachsene Menschen mit Typ-1-Diabetes, die Schwierigkeiten haben, eine gute Glukosekontrolle zu erreichen.
Quellen:
1. JAMA 2017; 317: 371-378
2. The Lancet Diabetes & Endocrinology, 10(10): 720-731
3. Diabetes Care 2019; 42: 1593-1603