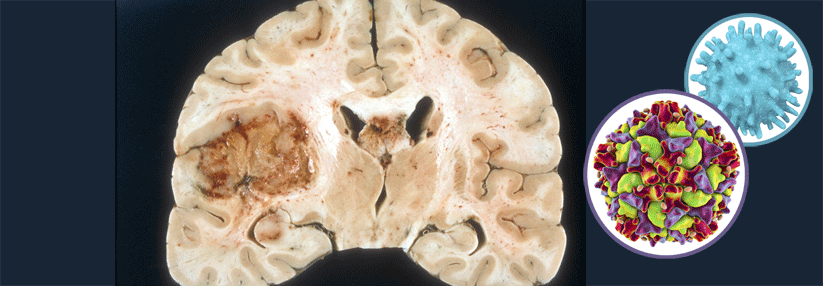
Krebs wegimpfen: Warum ist es so schwierig, eine geeignete therapeutische Vakzine zu finden?
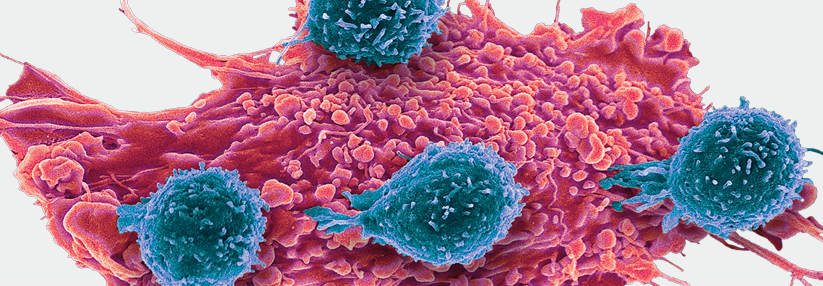 Erkennen T-Zellen (blau) mutierte Peptide, töten sie die Tumorzelle (rot) ab.
© Science Photo Library – Gschmeissner, Steve
Erkennen T-Zellen (blau) mutierte Peptide, töten sie die Tumorzelle (rot) ab.
© Science Photo Library – Gschmeissner, Steve
Das Prinzip therapeutischer Impfkonzepte besteht darin, Erkennungsstrukturen (z.B. Peptide) von Tumoren ausfindig zu machen und diese dem Patienten zu injizieren. Forscher hoffen, so das Immunsystem zu aktivieren, damit es den Tumor angreift und erfolgreich bekämpft. Die Grundidee ist einfach, die Umsetzung dagegen hochkomplex.
Beinahe jede Körperzelle exprimiert humane Leukozytenantigen(HLA)-Moleküle. Sie zeigen Änderungen im Bestand der zellulären Proteine an, wodurch T-Zellen sie erkennen können, schreibt das Team um Professor Dr. Hans-Georg Rammensee von der Abteilung Immunologie der Universität Tübingen. Bei nicht-pathologischen Peptiden passiert nichts, denn sie werden von den T-Zellen toleriert. Bei einer Virusinfektion dagegen präsentieren die HLA-Moleküle auch einige Moleküle aus Virusproteinen, die T-Zellen als fremd identifizieren.
Bei Krebserkrankungen können T-Zellen u.a. tumorspezifische Peptide oder mutierte Neoantigene erkennen. Letztere entstehen durch krankheitsbedingte Mutationen und unterscheiden sich in ihrer Aminosäuresequenz von ihren gesunden Gegenstücken.
Starke Immunantworten bei Glioblastompatienten
Tumorspezifische Peptide wären ideal für eine therapeutische Impfung, aber es gibt zwei Haken, die bisher größere Erfolge verhindert haben: Zum einen variieren die Peptide von Mensch zu Mensch, weil bösartige Zellen sehr verschieden sind und HLA-Gene einen ausgeprägten Polymorphismus aufweisen. Zum anderen gelang es bisher in klinischen Studien nicht, durch Impfung eine effektive T-Zell-Antwort gegen die Tumor-Peptide zu generieren. Was vermutlich daran liegt, dass geeignete Adjuvanzien fehlten.
Damit es dennoch gelingen kann, in Zukunft wirksame personalisierte Peptidimpfstoffe für Krebs-Patienten zu entwickeln, schlagen die Autoren folgendes Prozedere vor:
- Man entnimmt dem Patienten eine Tumorprobe und am besten auch gesundes Gewebe aus dem gleichen Organ. Die auf den HLA-Molekülen präsentierten Peptide werden getrennt und identifiziert.
- Der Vergleich zwischen den Peptiden von Tumor- und Normalgewebe und den mit Peptiden anderer Personen erlaubt es dann, diejenigen herauszufiltern, die für eine personalisierte Vakzine Erfolg versprechend erscheinen.
- In der Probe aus dem kranken Gewebe erfolgt parallel die Suche nach tumorspezifischen Mutationen bzw. Neoepitopen. Falls vorhanden, können diese Neoepitope zusammen mit nicht-mutierten Tumorantigenen den Impfstoff bereichern.
- Schließlich wird eine Auswahl von bis zu zehn Peptiden mit Adjuvans hergestellt, mit einem passenden Träger kombiniert und dann als personalisiertes Arzneimittel an den behandelnden Arzt gegeben.
Eine Studie mit Glioblastom-Patienten zeigte kürzlich, dass dieses Vorgehen Erfolg verspricht: Mehrmalige Injektionen führten zu starken vakzinspezifischen T-Zell-Antworten.
Die Autoren empfehlen, sich vor der Produktion und dem Einsatz einer solchen Peptidvakzine den besten Zeitpunkt für die Impfung zu überlegen. Die Anwendung ergibt nur dann Sinn, wenn ein geeignetes Verhältnis von Effektor-T-Zellen und Zielzellen vorliegt. Als Beispiel dafür nennen sie die adjuvante Phase nach einer Operation oder remissionsinduzierenden Standardtherapie, wenn nur noch wenige Resttumorzellen im Körper vorhanden sind.
Quelle: Rammensee H-G et al. Internist 2020; 61: 690-698; DOI: 10.1007/s00108-020-00814-z
