Diagnose Subklinisches Vorhofflimmern im Handy
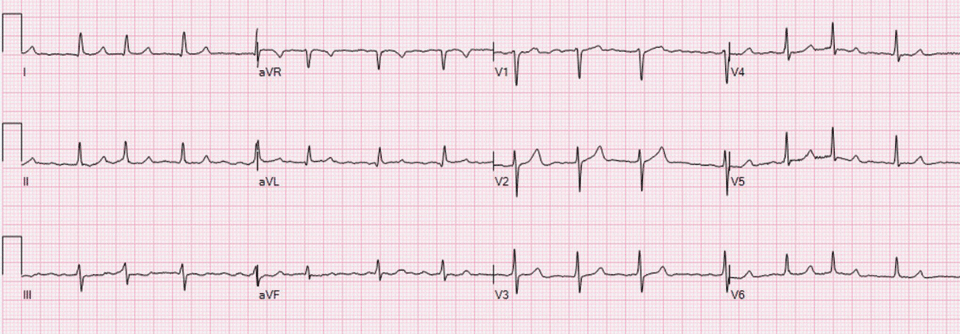 Erst wenn sich ein subklinisches Vorhofflimmern auch im 12-Kanal-EKG bestätigt, sollte man den Rezeptblock für ein orales Antikoagulans zücken.
© Ewingdo - wikimedia
Erst wenn sich ein subklinisches Vorhofflimmern auch im 12-Kanal-EKG bestätigt, sollte man den Rezeptblock für ein orales Antikoagulans zücken.
© Ewingdo - wikimedia
Die ESC* hat in ihrer Leitlinie zum Vorhofflimmern (VHF) den Begriff AHRE (Atrial High Rate Episodes) übernommen. Er bezeichnet ursprünglich von Herzschrittmachern oder implantierbaren Defibrillatoren registrierte Tachyarrhythmien auf Vorhofebene, die keinem vorbekannten VHF zuzuordnen sind, sich nicht im 12-Kanal-EKG zeigen und ohne Symptome einhergehen. Künftig könnten sie immer häufiger von Smartwatches und anderen Geräten entdeckt werden, was klinische Fragen aufwirft.
Prof. Dr. Giuseppe Boriani von der Universität Modena, Mitautor der Leitlinie, merkte zunächst an, dass die Definition der AHRE primär auf negativen Kriterien fußt. Hinzu kommt, dass es bisher keine Evidenz dafür gibt, wie Patienten mit subklinischem VHF zu behandeln sind. In zwei aktuellen Phase-4-Studien steht die frühe orale Antikoagulation (OAK) mit NOAK in diesen Fällen auf dem Prüfstand, Ergebnisse werden aber frühestens im zweiten Halbjahr 2023 vorliegen.
Evidenz für kardiologische Leitlinien generell mager
Auf der anderen Seite sehe die Evidenz für die aktuell empfohlenen Therapiemaßnahmen auch bei manifestem VHF nicht gut aus, und sie habe sich in den letzten zehn Jahren nicht weiterentwickelt, betonte Prof. Boriani. 2010 stützten sich 16 % von 214 Leitlinienempfehlungen auf randomisierte klinische Studien (RCT), also Level-A-Evidenz. 2020 waren es 17 % von 130 Empfehlungen. Eine starke Klasse-I-Empfehlung mit Evidenzgrad A bekamen 2010 26 % der Empfehlungen, 2020 kaum mehr (30 %). Allerdings ziehe sich das Problem durch die ganze Kardiologie: Auch andere wichtige Leitlinien bringen es im Schnitt nur auf 15 % hochklassige Evidenz. „Wir sollten uns davon im Management von subklinischem VHF nicht paralysieren lassen“, forderte Prof. Boriani. „Wir können uns eine nihilistische Haltung nicht leisten, während wir auf die RCT warten.“
Im Device entdecktes VHF wie immer nach Klinik managen
In seinen Augen greift es zu kurz, das Problem auf die Alternative „Antikoagulation – ja oder nein?“ zu reduzieren. Bevor man über Therapie diskutiert, sind offene Fragen zu klären: etwa nach der Heterogenität der Entität subklinisches VHF, der Patienten und ihrer Anamnese, der Signifikanz der Befunde und der Dynamik, nach Risikofaktoren und prognostischen Markern. „Ein per Device entdecktes VHF sollte anhand klinischer Kriterien gemanagt werden wie VHF sonst auch“, so der italienische Kollege. „Wir behandeln Patienten, nicht eine akzidentelle Arrhythmie!“
Ein Sonderfall ist subklinisches VHF, das vom Smartphone, der Smartwatch oder anderen Wearables angezeigt wurde. Dieser Fall wird Ärzte künftig zweifellos häufiger beschäftigen als bisher. Für die Diagnose VHF sei „die Bestätigung per 12-Kanal-EKG absolut zwingend“, betonte Prof. Boriani. „Wir sollten in solchen Situationen unbedingt den Terminus „vermutlich VHF“ vermeiden – VHF ist bestätigt oder nicht bestätigt.“
Die Dimension des Problems
Implantierbare Devices entdecken bei fast 30 % der Träger ein subklinisches Vorhofflimmern, wie eine aktuelle Metaanalyse von 54 Studien mit über 72.000 Teilnehmern zeigt. Der Altersgipfel lag jenseits des 70. Lebensjahres, und die betroffenen Patienten zeigten ein Risikofaktorenprofil, dass sie als hochgefährdet für einen Schlaganfall auswies. Eine weitere Metaanalyse ergab, dass Patienten mit AHRE ein 3,3-fach erhöhtes Risiko haben, ein manifestes VHF zu bekommen. Ihr Schlaganfallrisiko ist mehr als doppelt so hoch wie das von Menschen ohne AHRE, aber nicht einmal halb so hoch wie bei klinischem VHF.
Die Gefahr, dass sich aus einem subklinischen ein klinisches VHF entwickelt, ist für Patienten mit hohen Werten im CHA2DS2-VASc-Score und lang anhaltenden AHRE von 12 bis 24 Stunden besonders groß. Die ESC hat sich bei der australischen Heart Foundation eine pragmatische Leitschnur abgeschaut, die sich an Episodendauer und CHA2DS2-VASc orientiert. Patienten mit kurzen und seltenen Episoden brauchen demnach erst eine Überwachung, wenn ihr Score zwei Punkte oder mehr beträgt. Kurze, häufige Episoden sollten dagegen kontrolliert werden. Vor allem bei hohem Score kann in Einzelfällen auch eine OAK sinnvoll sein, wenn das Risiko für Blutungen niedrig ist. Länger als 24 Stunden dauernde, häufige AHRE brauchen die OAK umso dringender, je höher der Score ist. Ein wichtiger Aspekt ist ferner, ob der Patient bereits einen kardioembolischen Schlaganfall hinter sich hat. Das spricht dafür, schon bei subklinischem VHF rasch und konsequent zu antikoagulieren.
Hausärzte müssen bei der Antikoagulation mitziehen
Wichtig ist, die Hausärzte mit ins Boot zu holen. Prof. Boriani illustrierte das am Beispiel eines seiner Patienten, der wegen multipler lang dauernder AHRE ein NOAK erhalten hatte. Der Hausarzt setzte es nach sechs Monaten ab, weil er es für überflüssig hielt. Keine zwei Monate später erlitt der Patient einen ischämischen Schlaganfall. Ein klinisches VHF hatte er da immer noch nicht, das kam erst 16 Monate später.
„Wir sollten uns hüten, alle unsere Patienten mit subklinischem VHF zu antikoagulieren“, meinte Prof. Dr. Isabelle van Gelder, Universität Groningen. Außer Frage stehe, dass das Risiko mit der Arrhythmiedauer ansteigt – das sehe man ja bereits beim klinischen VHF, bei dem das Risiko von paroxysmal über persistent bis permanent immer mehr zunimmt. In einer eigenen Analyse der ASSERT-Studie konnte Prof. van Gelder zeigen, dass auch beim subklinischen VHF die Dauer zentrale Bedeutung hat. Die Patienten, die durch Hypertonie und Alter über 65 Jahre alle einen CHA2DS2-VASc von mindestens zwei Punkten hatten, zeigten nur dann ein erhöhtes Schlaganfallrisiko, wenn die Episodendauer 24 Stunden überstieg.
Eine wichtige Studie in diesem Kontext ist LOOP, die rund 6.000 Hochrisikoindividuen zwischen 70 und 90 Jahren mit Hypertonie, Diabetes, thromboembolischen Vorerkrankungen oder Herzinsuffizienz einschloss, bei denen kein VHF bekannt war. Ein Viertel der Teilnehmer erhielt einen implantierten Loop-Rekorder (ILR) zum Screening. Alle, bei denen ein VHF entdeckt wurde, ob per Rekorder oder per Zufall, wurden antikoaguliert. Das Ergebnis: In der ILR-Gruppe gab es dreimal so viele VHF-Diagnosen und dreimal so viel OAK wie in der Kontrollgruppe, aber gleich viele Schlaganfälle und systemische arterielle Embolien.
„Offenbar ist nicht jedes VHF es wert, entdeckt und antikoaguliert zu werden, zumal die Therapie nicht risikofrei ist“, so Prof. van Gelder. Sie plädierte dafür, Antikoagulation den Patienten mit dem höchsten Risiko vorzubehalten, wie es die Leitlinie vorsieht. In ihrer klinischen Praxis zieht sie die Grenze bei einem CHA2DS2-VASc-Score von vier Punkten und einer Arrhythmiedauer von vier Stunden pro Tag. Ab da diskutiert sie mit dem Patienten das Für und Wider der OAK. „Wichtig: Wenn man mit der OAK beginnt, dann konsequent und in angemessener Dosierung“, betonte die Kardiologin.
Möglich, dass sich die Nutzen-Risiko-Bewertung mit den ins Haus stehenden Faktor-XI-Inhibitoren noch einmal ändert. Sie scheinen ein geringeres Blutungsrisiko zu bergen als die bisherigen NOAK. „Sollten sie sich als ebenso wirksam in Sachen Schlaganfallprävention erweisen, würde ich mich schneller für die OAK entscheiden“, sagte Prof. van Gelder.
Quelle: ESC* Congress 2022 * European Society of Cardiology