Wann ist beim familiär gehäuften Darmkrebs die Gendiagnostik sinnvoll?
 Jeder fünfte Darmkrebs tritt familiär gehäuft auf.
© iStock.com/selvanegra
Jeder fünfte Darmkrebs tritt familiär gehäuft auf.
© iStock.com/selvanegra
Das mit einer Prävalenz von 1:500 häufigste erbliche Darmkrebssyndrom ist das hereditäre nicht-polypöse kolorektale Karzinom (HNPCC). Je nach mutiertem Gen unterscheidet man zwischen dem Lynch-Syndrom und dem familiären kolorektalen Karzinom Typ X.
Die Diagnose Lynch-Syndrom wird klassischerweise anhand der Amsterdam-II-Kriterien gestellt. Bei ungeklärten Familienverhältnissen oder lückenhaft dokumentierter Krankengeschichte kann das allerdings schwierig werden, denn das Schema setzt die Kenntnis der familiären Krebserkrankungen über drei Generationen voraus. Besteht der Verdacht auf ein HNPCC und die Kriterien werden, z.B. aufgrund einer unvollständigen Familienanamnese nicht erfüllt, sollten die revidierten Bethesda-Kriterien herangezogen werden (s. Kasten).
Die revidierten Bethesda-Kriterien
- Kolorektalkarzinom (KRC) vor dem 50. Lebensjahr
- syn- oder metachrone mit HNPCC assoziierte Tumoren (z.B. KRC, Endometrium-, Ovarial-, Magen-, Pankreaskarzinom) unabhängig vom Alter bei Diagnosestellung
- KRC vor dem 60. Lebensjahr mit typischer Histologie eines Tumors mit hohem Level an Mikrosatelliteninstabilität
- KRC-Patient mit Verwandten ersten Grades mit einem KRC oder einem HNPCC-assoziierten Tumor vor dem 50. Lebensjahr
- Patient mit KRC und mindestens zwei Verwandten ersten oder zweiten Grades, bei denen ein KRC oder ein HNPCC-assoziierter Tumor diagnostiziert wurde – unabhängig vom Alter
Keimbahnmutationen im Blut aufdecken
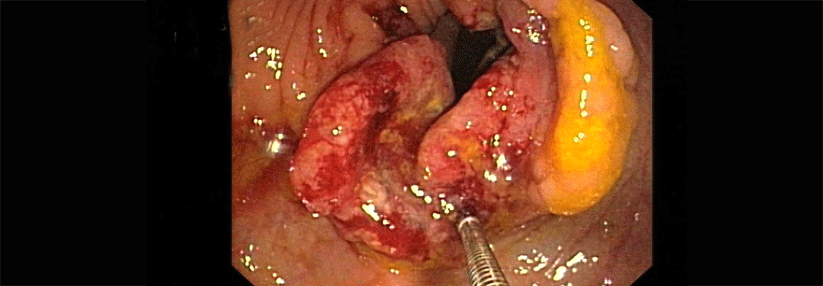
Trifft auch nur eines dieser Kriterien zu, ist eine Untersuchung des Tumormaterials auf Mutationen der DNA-Mismatch-Reparaturgene (MMR-Gene) und/oder Mikrosatelliteninstabilität indiziert, schreiben Dr. Melanie Isau von der Medicover Genetics GmbH in Berlin und die als ärztliche Psychotherapeutin niedergelassene Humangenetikerin Professor Dr. Elisabeth Gödde, Recklinghausen. Lassen sich Veränderungen nachweisen, erfolgt – ggf. nach Mutationsanalyse des BRAF-Gens – die molekulargenetische Untersuchung im Blut, um Mutationen der Keimbahn aufzuspüren. Männer erkranken häufiger an einem Lynch-Syndrom als Frauen. Allerdings ist bei Frauen mit Keimbahnmutation in einem der MMR-Protein-Gene auch das Risiko, an einem Endometriumkarzinom zu erkranken, im Vergleich zur Durchschnittsbevölkerung deutlich erhöht (70 % vs. 2 %). Ovarialkarzinome kommen bei Patientinnen mit bestimmten MMR-Mutationen ebenfalls sehr viel häufiger vor (20–24 % vs. 1,4 %). Da eine Früherkennung aktuell nicht zuverlässig möglich ist, entscheiden sich betroffene Frauen, die ihre Familienplanung bereits abgeschlossen haben, häufig für eine prophylaktische Operation.Polypenzahl ist entscheidend
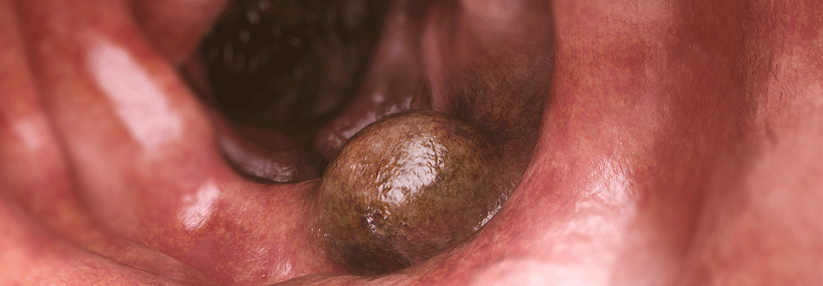
Beim familiären kolorektalen Karzinom Typ X (FCCTX), das je nach Literatur 50–60 % der HNPCC-Fälle ausmacht, wird keine Häufung von Malignomen in anderen Organen beobachtet. Von einem FCCTX ist auszugehen, wenn- entweder die Amsterdam-I-Kriterien erfüllt sind, aber keine Mutation in einem der MMR-Protein-Gene nachgewiesen werden kann,
- oder die Bethesda-Kriterien erfüllt sind, der Tumor aber keinen Verlust von MMR-Proteinen aufweist bzw. der Tumor mikrosatellitenstabil ist.
Vier weitere seltene Polyposis-Syndrome
Neben den bereits genannten gibt es weitere, noch seltenere Polyposis-Syndrome durch Mutationen in anderen Genen. Diese sind:- Polymerase-Proofreading-assoziierte Polyposis
- juveniles Polyposis-Syndrom
- Peutz-Jeghers-Syndrom
- Cowden-Syndrom
Verwandte aufklären und ausführlich beraten
Grundsätzlich gilt: Sobald klar ist, dass der Darmkrebs vererbbar ist, rücken auch die Nachkommen und andere direkte Verwandte der Betroffenen in den Fokus. Ihnen stellt sich die Frage: Gentest ja oder nein? Die molekulargenetische Diagnostik erfordert vor allem bei Nichterkrankten eine ausführliche Aufklärung und Beratung. Diese ist auch so im Gendiagnostikgesetz verankert. In der humangenetischen Beratung zur Frage einer erblichen Krebsdisposition spielen nicht nur anamnestische Kriterien eine Rolle. In besonderem Maße zählen auch die persönliche Perspektive und die Erwartungen der Betroffenen und ihrer Familien, betonen die Autorinnen. Entscheiden sich die gesunden Familienangehörigen für einen prädiktiven Test und stellt sich bei diesem heraus, dass auch sie Anlageträger sind, ist die Aufnahme in spezielle Früherkennungsprogramme und gegebenenfalls das Ergreifen prophylaktischer Maßnahmen sinnvoll. Damit auch nachfolgende Generationen die Möglichkeit haben, sich testen und ihr Risiko einschätzen zu lassen, empfehlen Dr. Isau und Prof. Gödde Erkrankten mit pathogener Mutation, ihre Befunde sorgfältig zu dokumentieren und ihren Familienmitgliedern bei Bedarf Zugriff darauf zu gewähren.Quelle: Isau M, Gödde E. Internistische Praxis 2018; 59: 604-622