
COPD Keine Therapie mehr von der Stange!
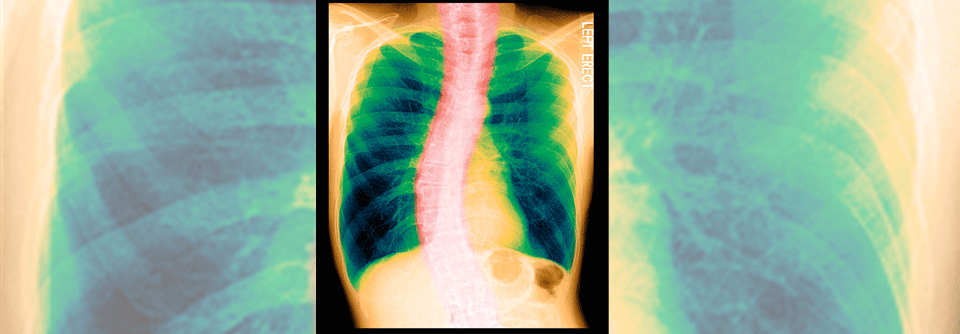 Dieser Patient ist Raucher und er leidet an einer COPD. Für seine verringerte Lungenfunktion ist aber auch die Skoliose verantwortlich, was bei vermeintlich geringem Therapieansprechen berücksichtigt werden muss.
© Science Photo Library/Medical Body Scans
Dieser Patient ist Raucher und er leidet an einer COPD. Für seine verringerte Lungenfunktion ist aber auch die Skoliose verantwortlich, was bei vermeintlich geringem Therapieansprechen berücksichtigt werden muss.
© Science Photo Library/Medical Body Scans
COPD-Patienten unterscheiden sich in vielerlei Hinsicht: Bei den einen kommt es rasch, bei den anderen langsam zum Lungenfunktionsverlust, die einen klagen über massive Atemnot, die anderen sind trotz schwerer Obstruktion beschwerdefrei (dies trifft in immerhin 40 % der Fälle zu). Mal stehen Exazerbationen im Vordergrund, mal die Dyspnoe. Dazu kommt mitunter eine Vielzahl an Komorbiditäten, die die COPD, ihren Verlauf oder die Therapie beeinflussen. Entsprechend individuell muss die Behandlung ausgerichtet werden, schreiben Prof. Dr. Nicholas Roche von der Université de Paris und Kollegen.
Zwei Phänotypen können zur COPD führen
Ob und wie sich die Lungenfunktion eines Patienten über die Zeit entwickelt, hängt vom Zusammenspiel von genetischen und Umweltfaktoren ab, die durch individuelles Verhalten moduliert werden. Prinzipiell geht man von zwei Phänotypen aus, die zu einer COPD führen können. Der eine ist charakterisiert durch eine normale FEV1 im jungen Erwachsenenalter und einem raschem Lungenfunktionsverlust in späteren Jahren. Bei dem zweiten liegt eine gestörte pulmonale Entwicklung in der Kindheit vor. Ausgehend von einem verminderten Level nimmt die Lungenfunktion über die Jahre in einem eher physiologischem Ausmaß ab. Wer bereits im frühen Erwachsenenalter eine FEV1 ≤ 80 % vom Soll aufweist hat ein erhöhtes Risiko für Komorbiditäten und vorzeitigen Tod, heißt es in dem Review der französischen Kollegen.
Einer dänischen Analyse zufolge entwickelt jeder siebte Raucher unter 50 Jahren mit einem Tabakkonsum von mindestens 10 Pack Years eine frühe COPD mit einer erniedrigten FEV1/FVC-Ratio, pulmonalen Auffälligkeiten in der CT und/oder einem beschleunigtem FEV1-Verlust (≥ 60 ml pro Jahr). Da bei solch einer Konstellation das Risiko für Exazerbationen, schwere Pneumonien und vorzeitigen Tod signifikant erhöht ist, könnte sich eine frühe Intervention lohnen. Diese scheitert nach Aussage der Autoren aber oft daran, dass der Lungenfunktionsverlust gar nicht erkannt wird.
Bis zu 90 % der COPD-Patienten haben mindestens eine Begleiterkrankung, etwa die Hälfte der Betroffenen sogar drei oder mehr. Dies wirkt sich nicht nur auf die Therapie, sondern auch auf das Outcome der Patienten aus, zumal sich COPD und Komorbidität wechselseitig beeinflussen können. Beispiel Herzinsuffizienz: Die pulmonale Überblähung bei COPD fördert mechanisch die Entwicklung einer Herzinsuffizienz. Die wiederum erhöht das Sterberisiko bei COPD je nach Studie um 30–90 %. Eine (steroidbedingte) Osteoporose liegt bei jedem siebten bis fünften COPD-Patienten vor und führt potenziell zu vertebralen Kompressionsfrakturen und Kyphoskoliose. Diese vermindert die Vitalkapazität und verstärkt die Dyspnoe.
Begleitende rheumatische Erkrankungen beeinträchtigen die körperliche Aktivität und treiben den Patienten in eine Negativspirale aus Inaktivität und weiterer pulmonaler Verschlechterung. Das Gleiche gilt für die Sarkopenie, die 25–30 % der COPD-Patienten betrifft. Klinisch relevant sind auch akute Infektionen. Die ambulant erworbene Pneumokokken-Pneumonie beispielsweise findet sich bei COPD-Kranken siebenmal häufiger als bei gleichaltrigen gesunden Menschen. Durch den Gebrauch von inhalativen Steroiden (ICS) steigt die Pneumoniegefahr weiter an.
Apropos ICS: Sie sind das Paradebeispiel dafür, dass eine COPD-Therapie differenziert und nicht nach Schema F erfolgen darf.
ICS/LABA nur für bestimmte Patienten der GOLD-Gruppe D
Patienten mit persistierender Dyspnoe sollten primär einen langwirksamen Bronchodilatator erhalten. Liegt der Wert im COPD Assessment Test (CAT) trotz wiederkehrender moderater Exazerbationen oder mindestens einer schweren Attacke unter zehn Punkten (GOLD-Gruppe C), ist in der Monotherapie ein LAMA zu bevorzugen.
Eine Initialtherapie mit ICS/LABA kommt nur für jene Patienten der GOLD-Gruppe D in Betracht, die eine Eosinophilenzahl ≥ 300/μl oder eine Asthmakomponente aufweisen, wobei GOLD D charakterisiert ist durch
- CAT ≥ 10 plus
- ≥ 2 mittelschwere akute Exazerbationen im vorangegangenen Jahr und/oder
- ≥ 1 schwere, hospitalisationspflichtige Exazerbation im vorangegangenen Jahr.
In der Praxis werden ICS jedoch öfter verordnet, als es bei leitliniengemäßem Einsatz zu erwarten wäre, kritisieren Prof. Roche und Kollegen. Sie geben zu bedenken, dass Asthma und COPD selten gemeinsam vorkommen und nur ein kleiner Teil der COPD-Patienten häufig exazerbiert – nach einer Studie aus England gerade mal 20 %. Trotzdem erhalten von den übrigen Kranken zwei Drittel ein ICS, oft im Rahmen einer Tripeltherapie.
Sie erinnern außerdem daran, dass Komorbiditäten wie Allergien, Infektionen, rheumatische und neoplastische Erkrankungen ebenfalls Ursache für einen Anstieg der Eosinophilen sein können. Auch müsse man vor der ICS-Verordnung die negativen Effekte auf potenziell vorhandene Komorbiditäten (u.a. Diabetes, Osteoporose) und behebbare Ursachen eines Nichtansprechens berücksichtigen. Zu Letzteren zählen körperliche Inaktivität, Rauchen, eine schlechte Adhärenz und der falsche Gebrauch von Inhalatoren.
Quelle: Roche N et al. ERJ Open Res 2021; DOI: 10.1183/23120541.00451-2021


