Therapieentscheidung bei Prostatakrebs Wer bin ich, und wenn ja: wie viele?
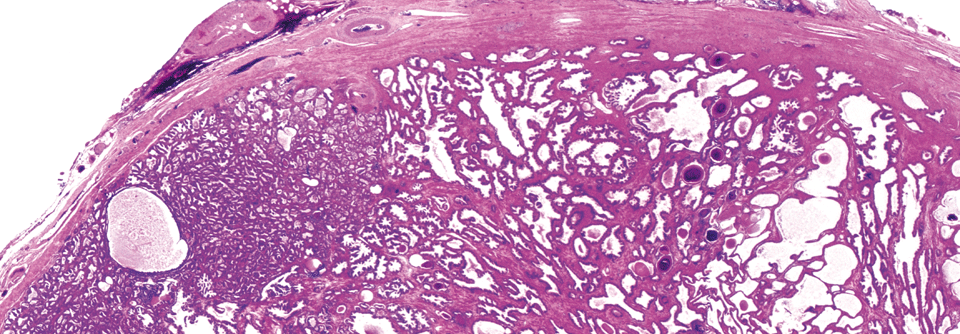 Leitlinienempfehlung: Bei einer Stanzbiopsie zehn bis zwölf Gewebezylinder entnehmen.
© Science Photo Library/ Microscape
Leitlinienempfehlung: Bei einer Stanzbiopsie zehn bis zwölf Gewebezylinder entnehmen.
© Science Photo Library/ Microscape
Die Zellen eines Karzinoms können sich gewaltig unterscheiden. Paradebeispiel dafür ist das Prostatakarzinom. „Das ist das Heterogenste, das man finden kann“, sagte Professor Dr. Matthias Saar.1 Auch wenn der Begriff eigentlich aus der Genetik stamme, beginne die Tumorheterogenität von Prostatakarzinomen bereits bei der Anatomie des Organs, erklärte der Direktor der urologischen Klinik der RWTH Aachen. Je nachdem, wo man eine Läsion finde, lasse sich bereits ihre Bedeutung abschätzen. So lägen im inneren Bereich der Vorsteherdrüse eher benigne Veränderungen, in der äußeren Zone dagegen maligne Strukturen.
Ein weiterer Punkt ist die Multifokalität, denn das Prostatakarzinom wächst selten gleichmäßig nur an einer Stelle. Daher kann eine Biopsiestanze komplett unauffällig bleiben, einen oder gleich mehrere Foci beinhalten. Finde man in einer Probe unterschiedliche Bereiche, lasse sich weder sagen, ob diese zu einer oder mehreren Läsionen gehörten, noch welcher Bereich repräsentativ sei, sagte der Urologe. Das kann man erst nach einer Prostatektomie beurteilen – und nicht selten weicht das Ergebnis von der präoperativen Einschätzung ab.
Hinzu kommt, dass jeder Fokus allein auch noch einmal heterogen erscheinen kann. Ein Umstand, dem auch die Bestimmung des Gleason-Scores anhand der Morphologie und Differenzierung des Zellgewebes Rechnung trägt.
Experte stellt Aussagekraft der Morphologie infrage
Erst einmal sei hier relevant, dass man es mit einem Tumor zu tun habe, äußerte Prof. Saar. Die Therapie richte sich dann nach der vermeintlich aggressivsten Ausprägung, also nach dem höchsten Gleason-Score. Je höher dieser ausfalle, umso mehr genetische Veränderungen seien zu erwarten, so der Experte. Im Fall von Gleason-7-Tumoren könne die Frequenz der Aberrationen bei bis zu 20 % liegen. Allerdings stelle sich die Frage, wie aussagekräftig eigentlich die Morphologie sei, wenn bei identischem Gleason-Score die Prognose differiere.
Ebenfalls wichtig: Ein Gleason 3+3, der eher als nicht therapiebedürftig eingestuft wird, sollte einen nicht in falscher Sicherheit wiegen. Es seien nämlich keinesfalls zwingend Hochrisiko-Läsionen, die später einmal metastasierten, mahnte Prof. Saar und verwies auf eine Publikation aus dem Jahr 2013.2
Darin berichten US-Wissenschaftler von einem Patienten, der 17 Jahre nach Erstdiagnose und Prostatektomie seinem Prostatatumor erlag. In der anschließenden Rapid Autopsy fanden sie mehrere Metastasen, deren Ursprung sie einer kleinen Gleason-6-Läsion zuordnen konnten und die nicht aus dem vorherrschenden schlechter differenzierten Gewebe stammten. Auch solche geringgradigen Strukturen können sich wie alle Tumoren mit der Zeit verändern und dabei unter Umständen aggressiver werden. Im vorliegenden Fall hatte aber die vermeintlich harmlosere Läsion bereits früh mikrometastasiert und eine PTEN- und TP53-Mutation aufgewiesen, was mit einer aggressiveren Erkrankung assoziiert ist.
Risikofaktoren für aggressive Verläufe bestimmen
Und nicht nur das: Die Metastasen hatten sich selbst weiter ausgebreitet und verändert. Zudem belegte der Vergleich mit einer Lymphknotenmetastase, die initial mit entfernt worden war, dass in dem Fall noch ein anderer Zellklon gestreut hatte.
Solche Prozesse sollte man nach Ansicht von Prof. Saar bedenken, wenn man einen Gleason-6-Tumor nur beobachten wolle. Er empfahl daher, Risikofaktoren für besonders aggressive Verläufe mit zu bestimmen, darunter etwa auch die BRCA-1/2-Mutationen.
Könnte man Patienten besser stratifizieren, müssten unter aktiver Überwachung vielleicht weniger Männer doch noch therapiert werden, so die Hoffnung des Experten. Die Kombination aus MRT und Künstlicher Intelligenz und das frühere Zusammenbringen von Radiologie und Pathologie könnten ein möglicher Lösungsansatz für die Zukunft sein.
Quellen:
1. Saar M. 73. Kongress der DGU; Session C4.2. und Interview
2. Haffner MC et al. J Clin Invest. 2013; 123: 4918-4922; DOI: 10.1172/JCI70354