Lokaltherapie Neue Mittel der Wundversorgung
 „Für das diabetische Fußulkus und Wunden auf dem Boden einer chronisch-venösen Insuffizienz ist die Therapie optimal“, meinte Prof. Stürmer.
© kirov1969 – stock.adobe.com
„Für das diabetische Fußulkus und Wunden auf dem Boden einer chronisch-venösen Insuffizienz ist die Therapie optimal“, meinte Prof. Stürmer.
© kirov1969 – stock.adobe.com
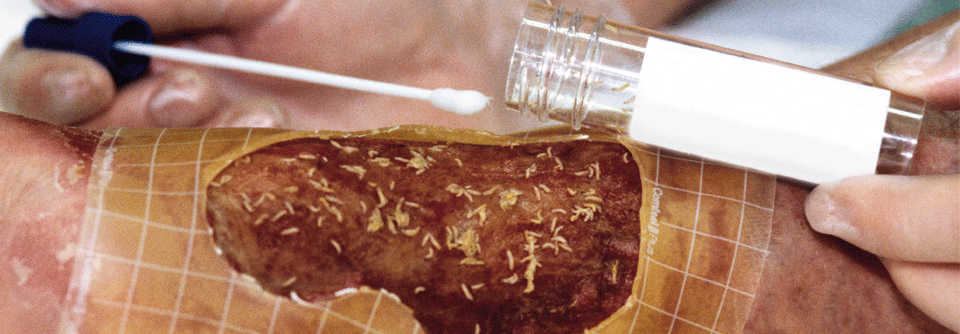
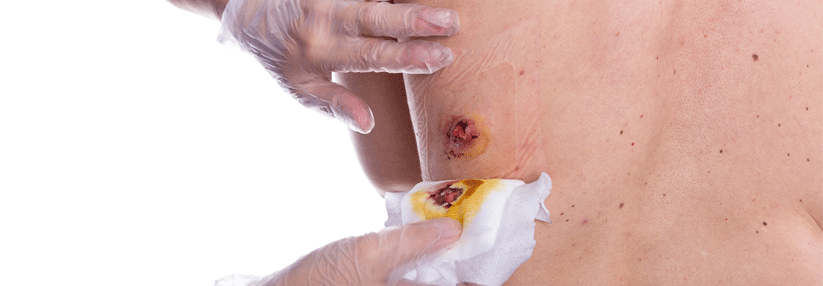
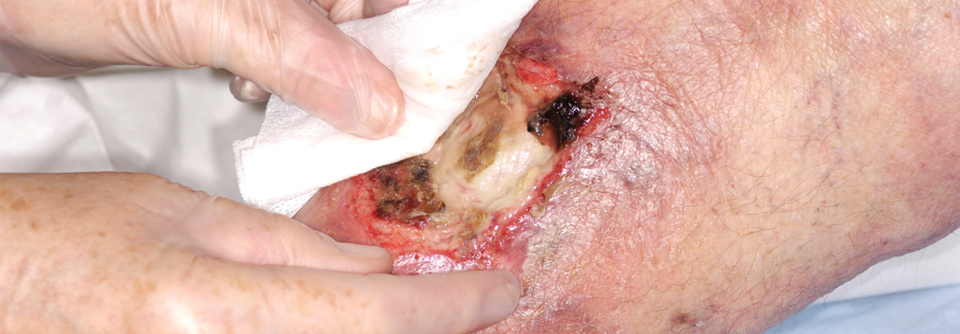
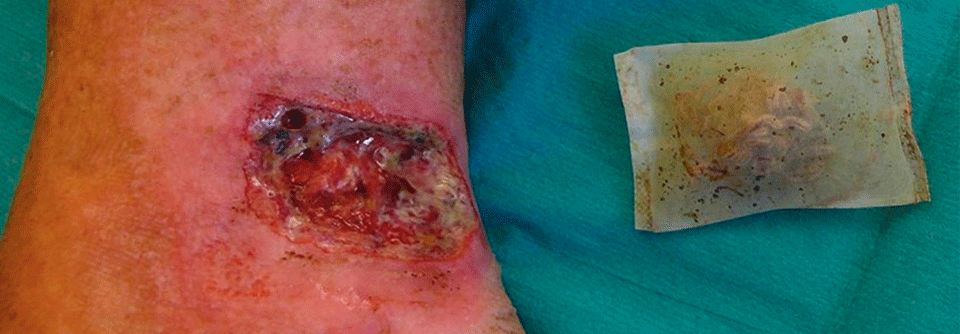
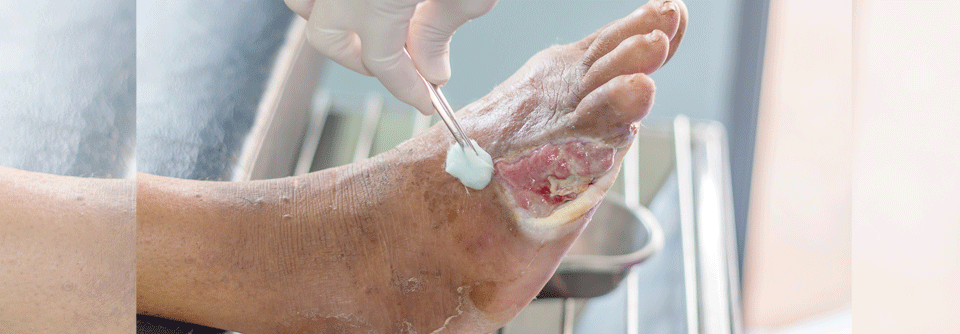
Für das Débridement gibt es ein neuartiges Gel, das als wesentlichen Wirkstoff Methansulfonsäure enthält, berichtete Prof. Dr. Ewa Klara Stürmer von der Klinik für Gefäßmedizin am Universitätsklinikum Hamburg-Eppendorf. Bakterien bilden eine extrazelluläre Matrix, bestehend aus Polysacchariden, Proteinen und Glykoproteinen. Insgesamt besteht ein Biofilm aber zu 97 % aus Wasser. Das Wasser stimuliert die Methansulfonsäure. Sie dringt in den Biofilm ein und „knackt“ die extrazelluläre Matrix: (Glyko-)Proteine denaturieren, mikrobielle Zellhüllen brechen auf, es kommt zur Dehydrierung durch Osmose. Das topische Débridement erfasst auch Wundbett und -ränder, daher kann es anfangs zu einer Vergrößerung der Läsionen kommen.
Das Gel muss einmal für 60 Sekunden angewendet werden, es eignet sich also gut zur ambulanten Therapie. Allerdings ist die Applikation etwas schmerzhaft. Die Behandlung sollte daher in Lokalanästhesie und unter Schutz der Umgebung erfolgen. „Für das diabetische Fußulkus und Wunden auf dem Boden einer chronisch-venösen Insuffizienz ist die Therapie optimal“, meinte Prof. Stürmer. Bei PAVK-Patienten schränkt die initiale Wundvergrößerung die Anwendung allerdings ein.
Plättchenreiches Plasma (PRP) enthält mehr als eine Million Plättchen pro Milliliter, darüber hinaus viele Wachstumsfaktoren wie platelet-derived growth factor, Zytokine, Antioxidanzien und extrazelluläre Matrixmodulatoren. Der Plasmaanteil liegt im Vergleich zu Blut um das Zwei- bis Achtfache höher. PRP unterstützt die Migration, Proliferation und Differenzierung von Wundzellen, die Stabilisierung von Endothelzellen sowie die Proliferation und Differenzierung von mesenchymalen Stammzellen.
„Es hat mich trotzdem anfangs nicht überzeugt, denn Bakterien mögen Plasma“, so Prof. Stürmer. Die Wirkung lässt sich durch Hyaluronsäure steigern. Sie verbessert die Aktivität verschiedener Moleküle im PRP, zugleich entzieht das Duo den Bakterien Wasser. Die Herstellung der Mixtur bleibt aber spezialisierten Zentren vorbehalten.
Auch Probiotika rückten in den letzten Jahren in den Fokus der Wundtherapeuten. In einer Studie mit 20 Diabetikern nahmen während der sechsmonatigen Einnahme eines Kombiproduktes Wundgröße und Schmerz deutlich ab. Die Patienten erhielten parallel ein Parodontitisscreening. Nach der Therapie zeigte sich eine geringere Taschentiefe trotz unveränderter Mundhygiene – laut Prof. Stürmer ein interessanter Nebenaspekt. Ihr Fazit: „Probiotika könnten uns womöglich künftig einen völlig anderen Therapieansatz bieten.“
Auch in der Diagnostik ist noch reichlich Luft nach oben
Generell muss man sagen, dass sich mit den Produktoptimierungen keine Quantensprünge, sondern nur kleine Fortschritte erzielen lassen, resümierte Prof. Stürmer. Und zugleich ist für alle Verfahren die Frage der Kostenerstattung derzeit weitgehend ungeklärt.
Bei allen Innovationen zur lokalen Behandlung sollte man darüber hinaus nicht vergessen, dass auch in der Diagnostik chronischer Wunden noch viel Luft nach oben ist. Hilfreich sind beispielsweise Hyperspektralanalysen. Sie liefern Informationen zu Sauerstoffsättigung und -aufnahme, Mikrozirkulation, Tiefenperfusion sowie Wassereinlagerungen. Zudem lassen sich mit ihnen infektiöse Hyperämien erkennen. Sie eignen sich zudem zur Behandlungskontrolle, man kann damit beispielsweise postoperativ das Gewebe beurteilen. „Im Grunde genommen entspricht die Analyse einer spektralen Biopsie“, sagte die Chirurgin.
Débridement künftig unter UV-Licht-Kontrolle?
UV-nahes Licht ist ebenfalls nützlich. Bei einer Bakteriendichte von mehr als 104 koloniebildenden Einheiten regt es die bakterielle Eigenfluoreszenz an, und Stoffwechselabbauprodukte der verschiedenen Keime leuchten darunter. Starke Kolonisationen und Infektionen lassen sich so sichtbar machen, bakterielle Ansammlungen werden abgrenzbar. Das hilft dabei, ein Débridement oder andere Therapien festzulegen, die man dann evtl. sogar UV-gestützt durchführen kann.
Quelle: 05. Nürnberger Wundkongress