Nach Asbest-Exposition – neue Erkenntnisse zum Pleuramesotheliom in der Leitlinie
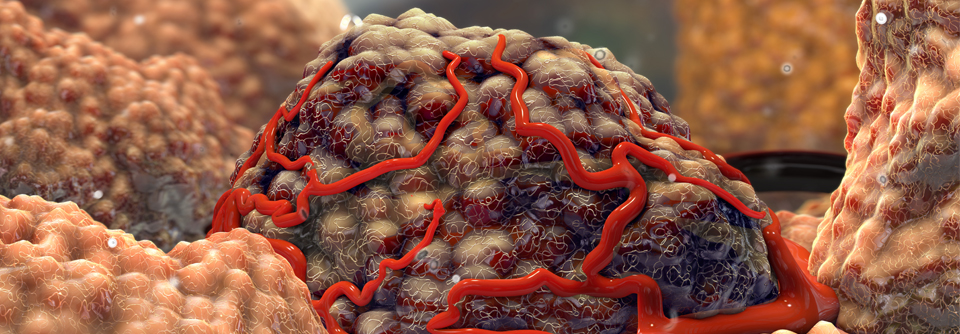
 Imposanter Anblick: eine Mesotheliomzelle im Rasterelektronenmikroskop.
© Science Photo Library/Gschmeissner, Steve
Imposanter Anblick: eine Mesotheliomzelle im Rasterelektronenmikroskop.
© Science Photo Library/Gschmeissner, Steve
Die letzte europäische Leitlinie datiert aus dem Jahr 2009. Vier Fachgesellschaften* haben nun die zwischen 2009 und 2018 publizierte Literatur gesichtet, um die Empfehlungen zu aktualisieren.
Das maligne Pleuramesotheliom (MPM) ist eine seltene Tumorerkrankung mit sehr schlechter Prognose. Zurückführen lässt sich das MPM hauptsächlich auf eine vorherige Asbest-Exposition mit einer Latenz von rund 40 Jahren. Eine klare Dosis-Wirkungs-Beziehung konnte zwar demonstriert werden, aber kein Schwellenwert, unterhalb dessen kein erhöhtes Risiko besteht.
Neue epidemiologische Daten stützen die Erwartung, dass der Inzidenzgipfel in Westeuropa etwa in diesem Jahr erreicht wird. Einige Länder in Asien, Osteuropa, Südamerika und Afrika verwenden immer noch Asbest, dort steht ein Anstieg der Fallzahlen noch bevor.
Pleurabiopsie bleibt Goldstandard
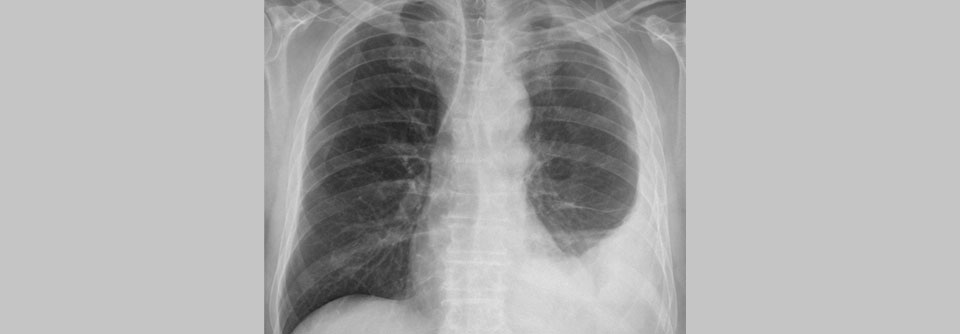
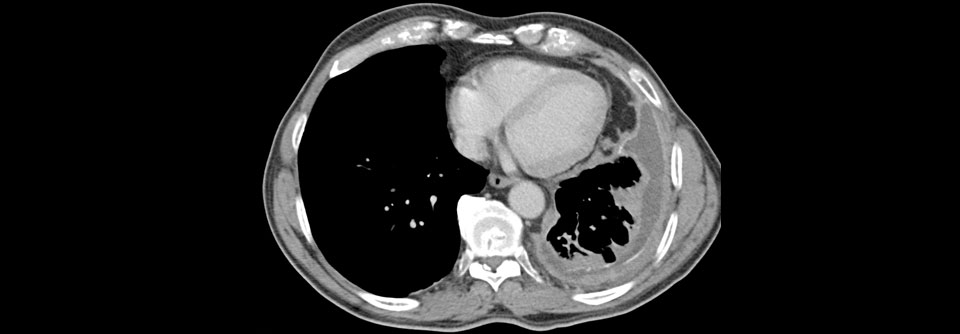
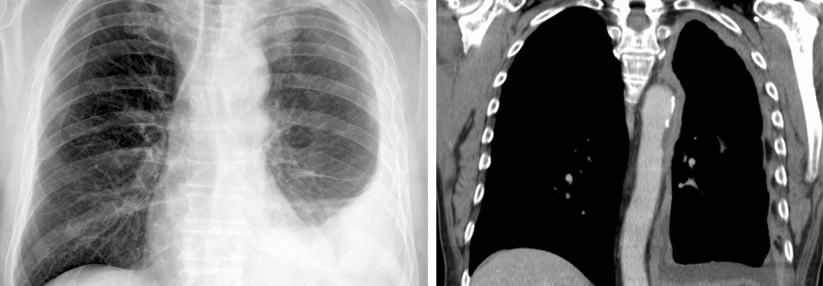
Pleura-Effusionen oder -Verdickungen im Röntgen-Thorax gelten als verdächtige Zeichen für ein MPM und sollten ein Kontrastmittel-CT nach sich ziehen. Die Pleurabiopsie bleibt der Goldstandard, um die Diagnose zu sichern, schreibt das Team um Professor Dr. Arnaud Schepereel vom Pulmonary and Thoracic Dept. am Centre Hospitalier Universitaire de Lille. Üblicherweise wird die Probenentnahme thorakoskopisch vorgenommen. Gelegentlich gewinnt man das Material auch mittels sonographisch oder CT-gesteuerter perkutaner Nadelbiopsie, z.B. bei Pleuraverdickungen ohne Effusionen oder Patienten in schlechtem Zustand.
Von großer Bedeutung sind inzwischen die interventionelle, von Pneumologen durchgeführte, sogenannte medizinische Thorakoskopie und die Video-assistierte Thoraxchirurgie (VATS). Sie bieten nicht nur eine hohe diagnostische Trefferquote, sondern haben auch den Vorteil, dass man damit einen symptomatischen Erguss entfernen oder eine Pleurodese durchführen kann. Außerdem erlauben sie ein Staging der Pleurahöhle.
Für die histologische Beurteilung reichen Standard-Färbemethoden in etwa 10 % der Fälle nicht aus. Das rechtfertigt den Einsatz spezifischer Marker für genetische Alterationen wie das BRCA1-associated protein (BAP-1) und das CDKN2A(p16)-Gen. Ein Verlust der BAP-1-Expression und/oder eine homozygote Deletion von CDKN2A (p16) kann ein MPM von einer benignen mesothelialen Proliferation abgrenzen.
Palliative Radiotherapie soll Schmerzen lindern
Steht die Diagnose, empfiehlt die Leitlinie therapeutisch an erster Stelle eine thorakoskopische Talkumpleurodese, um rezidivierende Pleuraeffusionen zu verhindern. Nur ausgewählte Patienten kommen für einen radikalen chirurgischen Eingriff infrage.
Eine palliative Radiotherapie kann man erwägen, um Schmerzen durch infiltrative Tumormanifestationen zu lindern. Trotz einiger ermutigender Ergebnisse befindet sich eine postoperative Radiotherapie noch im experimentellen Stadium, sodass es derzeit keine Empfehlung dafür gibt.
Chemotherapien wirken beim MPM nur sehr eingeschränkt. Doch neue Daten ändern nichts an der Empfehlung, bei fitten Patienten rasch eine Erstlinientherapie mit Platin und Pemetrexed (plus Folsäure und Vitamin B12) einzusetzen.
Untersucht wurden in den letzten Jahren einige neue zielgerichtete Medikamente und Immuntherapeutika. Zu Hoffnungen berechtigt insbesondere Bevacizumab als Ergänzung der Platin/Pemetrexed-Therapie. Erste positive Ergebnisse gibt es für manche Checkpoint-Inhibitoren. Doch es fehlt noch an Daten, um diese Substanzen vorschlagen zu können, insbesondere dazu, wie man sie optimal kombiniert. Deshalb sollten Patienten, die sich für einen multimodalen Therapieansatz eignen, in speziellen Zentren im Rahmen von klinischen Studien behandelt werden.
Bedeutung als Prognosefaktoren besitzen vor allem der Allgemeinzustand, der histologische Subtyp und das Tumorvolumen. Das Monitoring der Krankheitsprogression nach der aktiven Therapie soll sich am Auftreten klinischer Symptome wie Atemnot oder Schmerzen orientieren. Die Leitliniengruppe empfiehlt, alle 3–6 Monate eine CT-Kontrolle von Thorax und Abdomen einzuplanen. Für den Routineeinsatz von Biomarkern wie Mesothelin liegt keine ausreichende Evidenz vor.
* ERS – European Respiratory Society, ESTS – European Society of Thoracic Surgeons, EACTS – European Association for Cardio-Thoracic Surgery, ESTRO – European Society for Radiotherapy and Onocology
Quelle: Scherpereel A et al. Eur Respir J 2020; DOI: 10.1183/13993003.00953-2019